Zusammenfassung
- Definition:Gut- und bösartige Tumoren oberhalb des Foramen magnum, die vom Hirngewebe, den Hirnhäuten, den Hirnnerven oder der Hypophyse ausgehen. Erbliche Disposition und ionisierende Strahlung sind Risikofaktoren.
- Häufigkeit:Jährliche Inzidenz ca. 15–20/100.000.
- Symptome:Abhängig von Lokalisation, Art, Größe und Wachstumsrate: Häufige Anfangssymptome sind Kopfschmerzen, Übelkeit, Bewusstseinsveränderungen und Krampfanfälle.
- Befunde:Frühe Anzeichen können fokal-neurologische Ausfälle sein.
- Diagnostik:MRT und CT als bildgebende Verfahren sowie Biopsie mit histologischer Untersuchung.
- Therapie:Resektion, Strahlen- und Chemotherapie. Die Prognose hängt vor allem von histologischer und molekulargenetischer Charakterisierung, Tumorlokalisation und Alter ab.
Allgemeine Informationen
Definition
- Tumoren oberhalb des Foramen magnum, die vom Hirngewebe, den Hirnhäuten, den Hirnnerven oder der Hypophyse ausgehen.
- Sowohl gut- als auch bösartige Tumoren
- klare Unterscheidung nicht immer möglich, da z. T. auch maligne Transformation im Zeitverlauf (z. B. Gliome)
- Die korrekte histologische und molekulargenetische Diagnose ist entscheidend für die Wahl der Therapie sowie die Prognose.
WHO-Klassifikation
- ZNS-Tumoren wurden lange allein nach histopathologischen Kriterien klassifiziert, zuletzt in der WHO-Klassifikation von 2007.1
- Erstes Kriterium der Klassifizierung ist dabei die zelluläre Abstammung des Tumors (z. B. Astrozytom aus Astrozyten).
- Mit der Gradierung WHO I–IV wird zudem anhand histopathologischer Kriterien (nukleäre Pleomorphie, mitotische Aktivität, Nekrosen, Gefäßendothelproliferation) der Malignitätsgrad beschrieben:
- WHO I: geringe Proliferation, Heilung häufig allein durch Resektion
- WHO II: noch geringe proliferative Aktivität, aber infiltratives Wachstum
- WHO III: maligner Tumor
- WHO IV: rasch wachsender maligner Tumor.
- Der WHO-Grad korreliert grundsätzlich mit der Prognose, innerhalb eines WHO-Grades kann es aber zu deutlich unterschiedlichen Überlebenskurven kommen.
- In der Revision der WHO-Klassifikation von 2016 werden erstmals zusätzlich zu den fortbestehenden histopathologischen Kriterien auch molekulargenetische Marker zur Klassifikation verwendet.2-3
- Für die molekulargenetische Charakterisierung werden Genmutationen oder Chromosomendeletionen der Tumoren erfasst, u. a.:4
- Mutation von IDH (Isozitrat-Dehydrogenase)-1
- LOH („Loss of Heterozygozity“) von 1p/19q
- Methylierung des Promotors der MGMT-(Methylguanin-Methyltransferase).
- Für die molekulargenetische Charakterisierung werden Genmutationen oder Chromosomendeletionen der Tumoren erfasst, u. a.:4
- Die histopathologischen Parameter behalten dabei ihren Stellenwert, durch die zusätzliche Angabe molekularer Marker entstehen aber Tumorgruppen mit einheitlicherer Prognose und einheitlicherem Therapieansprechen.
- Die integrierte neuropathologische Diagnose basiert somit nun neu auf 3 statt auf 2 Diagnoseebenen:
- histologische Artdiagnose (z. B. Astrozytom)
- histologische Gradierung (z. B. WHO-Grad II)
- molekulargenetische Charakterisierung (z. B. IDH-mutiert).
- Tumorgruppen der WHO-Klassifikation 2016 (die zahlreichen einzelnen Tumorarten jeder Gruppe sind nicht aufgeführt):2
- diffuse astrozytäre und oligodendrogliale Tumoren
- andere astrozytäre Tumoren
- ependymale Tumoren
- andere Gliome
- Choroid-Plexus-Tumoren
- neuronale und neuronal-glial gemischte Tumoren
- Tumoren der Pinealisregion
- embryonale Tumoren
- Tumoren der kranialen und paraspinalen Nerven
- Meningeome
- mesenchymale, nicht-meningeotheliale Tumoren
- melanozytische Tumoren
- Lymphome
- histiozytische Tumoren
- Keimzelltumoren
- Tumoren der Sellaregion
- Metastasen.
Häufigkeit
- Inzidenz ca. 17/100.000 bei Männern und 20/100.000 bei Frauen
- Prävalenz in der Altersgruppe zwischen 55 und 64 Jahren am höchsten5
- Lebenszeitprävalenz ca. 0,6 %5
- Ca. 60 % der primären intrakraniellen Tumoren sind bösartig.
- Primäre intrakranielle Tumoren 3 % aller Malignome bei Erwachsenen, bei Kindern 30 %
- Verteilung der Tumorarten
- Meningeome 35 %
- Gliome 22 %
- davon ca. 75 % Glioblastome
- Tumoren der Sellaregion 14 %
- überwiegend Hypophysenadenome6
- Schwannome 6 %
- primäre ZNS-Lymphome 3 %
- embryonale Tumoren 1 %
- v. a. Medulloblastome
- Bei Erwachsenen sind Glioblastome und Meningeome am häufigsten.
- Bei Kindern sind Astrozytome, Medulloblastome, Ependymome und Kraniopharyngeome am häufigsten.
- Bei Erwachsenen sind die Tumoren meistens supratentoriell (im Großhirn).
- Auch bei Kindern überwiegend supratentorielle Lokalisation, aber größerer Anteil infratentorieller Tumoren (im Kleinhirn und im Hirnstamm)
- Intrakranielle Metastasen extrakranieller Malignome sind weitaus häufiger als primäre intrakranielle Tumoren.
Ätiologie und Pathogenese
Erbliche Disposition und Risikofaktoren
- Erbliche Disposition und ionisierende Strahlung sind Risikofaktoren.
- Kein Nachweis eines Zusammenhangs primärer intrakranieller Tumoren mit:5
- Konsum von Tabak oder Alkohol
- Nutzung von Mobiltelefonen
- Exposition gegenüber Hochspannungsleitungen
- Infektionen
- Verwendung von Haarfärbemitteln.
- Zusammenhang mit genetischen Erkrankungen
- Neurofibromatose Typ 1: Assoziation mit niedriggradigen Gliomen (insbes. Astrozytomen im Opticus-Chiasma-Hypothalamus)
- Neurofibromatose Typ 2: Assoziation mit Vestibularis-Schwannomen, Meningeomen und Gliomen (insbesondere Ependymomen)
- tuberöse Sklerose: Assoziation mit Astrozytomen (subependymales Riesenzellastrozytom)
- Von-Hippel-Lindau-Syndrom: Assoziation mit kapillären Hämangioblastomen
- Turcot-Syndrom: Assoziation mit Glioblastomen und Medulloblastomen
- Li-Fraumeni-Syndrom: Assoziation mit Medulloblastomen und Astrozytomen
Ausbreitung und Gewebearten
- Ausbreitung von primären Hirntumoren
- lokale Infiltration, z. B. entlang der Basalmembranen der Blutgefäße (Gliome)
- mit dem Liquor (Medulloblastome)
- Metastasen primärer Hirntumoren selten
- Gewebearten: Primäre Tumoren können von allen Gewebearten ausgehen, die in der Schädelhöhle vorkommen.
- größter Teil Gliome (Astrozytom, Oligodendrogliom, Ependymom)
- Meningeome entspringen den Hirnhäuten.
- Schwannome entstehen in den Hirnnerven (Akustikusneurinom).
- Hypophysenadenome
- in seltenen Fällen Entstehung in Neuronen (z. B. Gangliogliom) oder embryonalen Zellen (z. B. Medulloblastom)
- häufiger bei Kindern als bei Erwachsenen
Neuroepitheliale Tumoren
- Häufigste primäre Hirntumoren
- Entstehung aus Gliazellen oder Neuronen, d. h. aus Zellen, die von Neuroepithelien abstammen.
- Tendenz zur diffusen Infiltration
- eingeschränkte Möglichkeit zur radikalen chirurgischen Therapie
- Seltene Metastasierung
- Gliom ist der Sammelbegriff für Tumoren, die histologisch bestimmten Gliazellen (Astrozyten, Oligodendrozyten, Ependymzellen) ähneln.
Astrozytom
- Pilozytisches Astrozytom (WHO-Grad I): Astrozytom-Variante mit niedrigem Malignitätsgrad
- gut abgegrenzte, langsam wachsende Tumoren
- Auftreten am häufigsten im Kinder- und Jugendalter
- nur selten Tendenz zu maligner Transformation
- Vorkommen vor allem im Kleinhirn, im Nervus opticus und im Hypothalamus
- Astrozytome WHO-Grad II und anaplastische Astrozytome (WHO-Grad III) sind Untergruppen mit zunehmendem Malignitätsgrad.
- Entartung zu Glioblastom (WHO-Grad IV) möglich
Oligodendrogliom
- Auftreten am häufigsten im Alter zwischen 40 und 50 Jahren
- Lokalisation in der Regel in der Großhirnhemisphäre
- Auch hier Unterscheidung zwischen niedrigem (WHO-Grad II) und hohem (anaplastisch, WHO-Grad III) Malignitätsgrad
- Zusammenhang zwischen histologischem Befund und Prognose nicht so klar wie bei Astrozytomen
- Auch hier maligne Transformation zu Glioblastom möglich
Glioblastom
- Bösartigster primärer Hirntumor (WHO-Grad IV)
- Schnell und infiltrierend wachsend
- Alter bei Erstdiagnose meist 55–65 Jahre
- Entstehung de novo (primäres Glioblastom, häufiger) oder aus niedriggradigen Gliomen (sekundäres Glioblastom)
Neuronale Tumoren
- Neuronale und gemischte, neuronal-gliale Tumoren (dysembryoplastischer neuroepithelialer Tumor, Gangliogliom und zentrales Neurozytom)
- Selten
- Insgesamt gute Prognose
- maligne Transformation bei Gangliogliomen möglich
- Lokalisation von neuronalen und neuronal-glialen Tumoren oft in den Temporallappen
- Verursachen häufig Krampfanfälle.
- Zentrale Neurozytome in der Regel intraventrikuläre Tumoren
- Lokalisation meistens in der Nähe der Foramina interventriculares
- Auftreten am häufigsten bei jungen Erwachsenen
Meningeome7
- Etwa 35 % der primären intrakraniellen Tumoren8
- Entstehung aus den Deckzellen der Arachnoidea
- 95 % gutartig
- Häufigkeitsgipfel um 45. Lebensjahr
- Frauen sind häufiger betroffen als Männer (ca. 2:1).
- Häufigkeit des Mammakarzinoms bei Frauen mit Meningeom erhöht
- beide Tumorarten z. T. mit Hormonrezeptoren
- Beeinflussung durch weibliche Sexualhormone
- Meistens gut abgegrenzt, von Kapsel umgeben
- Langsames, verdrängendes Wachstum
- Tumoren häufig relativ groß bei Symptombeginn
Tumoren der Hirnnerven
- Vestibularis-Schwannom (früher Akustikusneurinom genannt)
- Häufigste primäre infratentorielle Tumorart (6 % der primären intrakraniellen Tumoren)
- Auftreten zwischen 45. und 70. Lebensjahr, bei Frauen etwas häufiger als bei Männern
- Gutartiges Neurinom, ausgehend von den Schwannzellen
- Langsames Wachstum
- Ausgang vom vestibulären Anteil des 8. Hirnnerven, Lage daher im Kleinhirnbrückenwinkel
- 95 % unilateral, 5 % bilateral
- bilaterales Vestbularis-Schwannom bei Neurofibromatose Typ 2
- Sehr selten Neurinome des 5. Hirnnerv (Nervus trigeminus)
Lymphome
- Primäre maligne Lymphome des ZNS sind i. d. R. B-Zell-Lymphome.
- Zunehmende Häufigkeit, u. a. bei HIV-Patient*innen und bei immunsupprimierten9, aber auch bei immunkompetenten Patient*innen
Hypophysentumoren
- Gehen von der Adenohypophyse aus.
- Ca. 10 % der intrakraniellen Tumoren6
- Auftreten zwischen 30. und 60. Lebensjahr
- Erhebliche Unterschiede in der Größe, der Wachstumsrate, dem klinischen Erscheinungsbild und der Invasion in das umliegende Gewebe
- Etwa 10 % lokal invasiv
- Infiltration in 1. Linie in die Wände der Sella turcica
- Metastasierende Hypophysenkarzinome extrem selten
- Hormonaktive Tumoren eher bei jüngeren, hormoninaktive Tumoren eher bei älteren Patient*innen
- Einteilung nach der Hormonproduktion
- 25–30 % Prolaktin
- 20–25 % nicht Hormon produzierend
- 15–20 % Somatotropin
- 10–15 % ACTH (Cushing-Syndrom)
- 5 % sowohl Prolaktin als auch Somatotropin
- 3–5 % Gonadotropine (LH und FSH)
- TSH-produzierende Tumoren selten
- Einteilung nach der Größe
- Mikroadenom (< 10 mm)
- Makroadenom (≥ 10 mm)
Metastasen
- Häufigkeit
- Ca. 25 % der Malignom-Patient*innen entwickeln Hirnmetastasen.
- Primärtumoren der Metastasen
- Bronchial-Ca (50 %)
- Mamma-Ca (15–20 %)
- gastrointestinale Tumoren, Melanom und urogenitale Tumoren jeweils 5–10 %
- Das Risiko für zerebrale Metastasen ist abhängig vom Primärtumor.
- malignes Melanom und kleinzelliges Bronchial-Ca 40 %
- nichtkleinzelliges Bronchial-Ca 30 %
- Mamma- und Nierenzell-Ca 20 %
- maligne Lymphome 2–5 %
Prädisponierende Faktoren
- Seltene Erbkrankheiten
- Ionisierende Strahlen
- Immunsuppression (primäre ZNS-Lymphome)
- Kein Nachweis eines Zusammenhangs mit Schädeltraumata
- Kein Nachweis eines Zusammenhangs mit dem Gebrauch von Mobiltelefonen10
ICPC-2
- N74 Bösartige Neubildung Nervensystem
- N75 Gutartige Neubildung Nervensystem
- N76 Neubild. Nervensystem nicht spez.
ICD-10
- C70 Bösartige Neubildung der Meningen
- C70.0 Hirnhäute
- C70.1 Rückenmarkhäute
- C70.9 Meningen, nicht näher bezeichnet
- C71 Bösartige Neubildung des Gehirns
- C71.0 Zerebrum, ausgenommen Hirnlappen und Ventrikel
- C71.1 Frontallappen
- C71.2 Temporallappen
- C71.3 Parietallappen
- C71.4 Okzipitallappen
- C71.5 Hirnventrikel
- C71.6 Zerebellum
- C71.7 Hirnstamm
- C71.8 Gehirn, mehrere Teilbereiche überlappend
- C71.9 Gehirn, nicht näher bezeichnet
- C72 Bösartige Neubildung des Rückenmarkes, der Hirnnerven und anderer Teile des Zentralnervensystems
- C72.0 Rückenmark
- C72.1 Cauda equina
- C72.2 Nn. olfactorii [I. Hirnnerv]
- C72.3 N. opticus [II. Hirnnerv]
- C72.4 N. vestibulocochlearis [VIII. Hirnnerv]
- C72.5 Sonstige und nicht näher bezeichnete Hirnnerven
- C72.8 Gehirn und andere Teile des Zentralnervensystems, mehrere Teilbereiche überlappend
- C72.9 Zentralnervensystem, nicht näher bezeichnet
- D32 Gutartige Neubildung der Meningen
- D32.0 Hirnhäute
- D32.1 Rückenmarkhäute
- D32.9 Meningen, nicht näher bezeichnet
- D33 Gutartige Neubildung des Gehirns und anderer Teile des Zentralnervensystems
- D33.0 Gehirn, supratentoriell
- D33.1 Gehirn, infratentoriell
- D33.2 Gehirn, nicht näher bezeichnet
- D33.3 Hirnnerven
- D33.4 Rückenmark
- D33.7 Sonstige näher bezeichnete Teile des Zentralnervensystems
- D33.9 Zentralnervensystem, nicht näher bezeichnet
Diagnostik
Differenzialdiagnosen
- Trauma: chronisches Subduralhämatom
- Vaskulär: Hämatome, Aneurysmen, arteriovenöse Malformation, Hirninfarkt, Venenthrombose
- Infektion: Abszess, Tuberkulom, Enzephalitis
- Anderes: Zysten, granulomatöse Entzündung bei Sarkoidose
Anamnese
- Unterschiedliche Symptomatik abhängig von Lokalisation, Art des Tumors und Wachstumsrate
- Klinische Verdachtssymptome für eine intrakranielle Raumforderung sind:
- Zeichen erhöhten Hirndrucks wie Kopfschmerzen, Vigilanzminderung, Übelkeit/Erbrechen
- fokale oder generalisierte epileptische Anfälle
- Persönlichkeitsveränderungen
- neurologische Herdsymptome
- Sehstörungen.
- Hypophysentumoren bewirken hormonelle Veränderungen, die zu Amenorrhö, Infertilität, Impotenz, Galaktorrhö, Akromegalie, Gigantismus oder Cushing-Syndrom führen können.
- Bei Blutungen im Tumor ist eine akute, schlaganfallsartige Symptomatik möglich.
Klinische Untersuchung
- Neurologische Untersuchung zur Dokumentation der durch den Tumor bei Diagnosestellung verursachten Defizite
- große Bedeutung auch zur Beurteilung späterer Folgen von Tumorprogression und Therapie
- Gleiches gilt für neuropsychologische Untersuchungen.
- z. B. Mini-Mental-Status
- Klinisch-internistische Untersuchung
- unter besonderer Berücksichtigung der Differenzialdiagnose primär extrazerebraler, metastasierender Tumoren
- auch zur Beurteilung der Operationsfähigkeit
- Mögliche Befunde bei intrazerebralem Druckanstieg:
- Stauungspapille
- Anisokorie
- Hypertonie
- Bradykardie
- verändertes Atemmuster.
- Als ein Ergebnis der klinisch-neurologischen Untersuchung ist der Karnofsky-Index festzulegen.
Karnofsky-Index zur Bewertung des Behinderungsgrades der Patient*innen
- 100 – Normalzustand, keine Beschwerden, keine manifeste Erkrankung
- 90 – Normale Leistungsfähigkeit, minimale Krankheitssymptome
- 80 – Normale Leistungsfähigkeit mit Anstrengung, geringe Krankheitssymptome
- 70 – Eingeschränkte Leistungsfähigkeit, arbeitsunfähig, kann sich selbst versorgen.
- 60 – Eingeschränkte Leistungsfähigkeit, benötigt gelegentlich fremde Hilfe.
- 50 – Eingeschränkte Leistungsfähigkeit, braucht krankenpflegerische und ärztliche Betreuung, nicht dauernd bettlägerig.
- 40 – Bettlägerig, spezielle Pflege erforderlich
- 30 – Schwer krank, Krankenhauspflege notwendig
- 20 – Schwer krank, Krankenhauspflege und supportive Maßnahmen erforderlich
- 10 – Moribund, Krankheit schreitet schnell fort.
- 0 – Tod
Diagnostik bei Spezialist*innen
- MRT: ohne und mit Kontrastmittel Methode der Wahl bei klinischem Verdacht auf einen Hirntumor
- Vorteile: hohe Sensitivität, Festlegung der Tumorlokalisation und -grenzen in mehreren Ebenen
- Nachteil: Darstellung von Kalzifikationen problematisch
- CT
- Vorteil: gute Darstellung von knöchernen Strukturen, Blutungen, Kalzifikationen
- Nachteil: schlechtere Auflösung von Weichteilgewebe als mit MRT
- Zerebrale Angiografie
- nur selten indiziert, z. B. bei Verdacht auf gefäßreiche Tumoren oder differenzialdiagnostisch in Bezug auf Gefäßfehlbildungen
- Häufig liefern MRT-Angiografie oder CT-Angiografie ausreichende Darstellung der Gefäßverhältnisse.
- Positronenemissionstomografie (PET)
- zur Differenzialdiagnose zwischen Veränderungen durch Tumor vs. Therapie
- höhere Spezifität für Tumorgewebe im Vgl. zum MRT
- zur Differenzialdiagnose zwischen Veränderungen durch Tumor vs. Therapie
Ergänzende Untersuchungen
- Stereotaktische Biopsie
- Neuroonkologisches Therapiekonzept erfordert histologische Beurteilung des Tumors.
- Biopsie führt bei mehr als 90 % der Patient*innen zu einer zuverlässigen Diagnose.
- bei Erwachsenen Biopsie zumeist in Lokalanästhesie
- Dadurch ist auch bei reduziertem Allgemeinzustand eine definitive Diagnose möglich.
- Liquoruntersuchung
- Dient zur Differenzialdiagnose.,
- Entzündung
- Metastasen eines extrazerebralen Tumors
- Meningealbeteiligung eines zerebralen Lymphoms
- meningeale Aussaat eines Medulloblastoms
- Dient zur Differenzialdiagnose.,
- EEG
- Überwachung einer tumorassoziierten Epilepsie
- Ermittlung der Ursachen für Bewusstseinsveränderungen
- weitere Therapieplanung bei symptomatischen Anfällen
- Hormonbestimmung im peripheren Blut
- wichtig bei Hypophysentumoren
Screening
- Früherkennung spielt keine wesentliche Rolle.
- Lediglich bei seltenen hereditären Syndromen mit Neigung zur Gliomentwicklung (z. B. Neurofibromatose) wird Bildgebung zum Screening eingesetzt.
Indikationen zur Überweisung
- Bei V. a. primären Hirntumor
Therapie
Therapieziele
- Heilung, wenn möglich
- Ansonsten lebensverlängernde Therapie mit Erhaltung der neurologischen Funktion
- In einigen Fällen symptomatische Therapie
Allgemeines zur Therapie
- Tumorspezifische Therapiemaßnahmen sind Operation, Bestrahlung und Chemotherapie.
- Ergänzende Behandlung von Krampfanfällen, peritumoralen Ödemen, Venenthrombosen, Müdigkeit und kognitiver Dysfunktion11
- Zu primären intrakraniellen Tumoren bei Kindern siehe Artikel ZNS-Tumoren bei Kindern.
Operative Therapie
- Wenn möglich, vollständige Exstirpation des Tumors
- Ansonsten möglichst umfassende Resektion des Tumors, vereinbar mit gutem funktionellem Ergebnis
- Zur Funktionserhaltung ist ein günstiger operativer Zugangsweg wichtig.
- Mikrochirurgische Operationstechniken sind erforderlich.
- Meistens neuronavigationsgestützte Operation
- Navigationssysteme können in zwei Hauptgruppen unterteilt werden:
- Systeme, die sich auf präoperative Bilder stützen (MRT, CT).
- Systeme, die sich auf intraoperative Bilder stützen (MRT, Ultraschall).
- Vorteil der intraoperativen Bildregistrierung: Anpassung an „Brain Shift“ während der Operation.
- Navigationssysteme können in zwei Hauptgruppen unterteilt werden:
- Postoperative MRT innerhalb von 24–48 h zur Beurteilung des Ergebnisses und Erfassung von Frühkomplikationen
- Evtl. Zweitoperation bei chirurgisch angehbarem Resttumor
- Hohes operatives Risiko bei Tumoren nahe der Schädelbasis
- Verbesserte Prognose bei einigen Tumoren durch vollständige Resektion, z. B. Glioblastom und niedriggradige Gliome
- Aufgrund eines diffusen Wachstums und schwieriger makro- und mikroskopischer Abgrenzung ist häufig eine Ergänzung durch Bestrahlung und Chemotherapie notwendig.
Strahlentherapie
- Ziele
- postoperative Zerstörung von Resttumorgewebe (vollständige operative Tumorresektion häufig nicht sicher beurteilbar bzw. primär nicht möglich)
- Strahlentherapie verlängert, insbesondere bei geringer Resttumormasse, die Überlebenszeit bei guter Lebensqualität.
- Mögliche Zielvolumina
- erweiterte Tumorregion (z. B. Gliome, Kraniopharyngeome)
- Ganzhirnbestrahlung (z. B. primäre ZNS-Lymphome, Leukämien, Metastasen)
- gesamter kraniospinaler Liquorraum (Neuroachse), z. B. Medulloblastom
- Planung
- individuelle, computergestützte Therapieplanung unter Berücksichtigung der Ergebnisse der Bildgebung (MRT, CT, PET)
- Art der Durchführung
- Standard ist die konventionelle dreidimensionale Strahlentherapie.
- Neuere Methoden der fokussierten Strahlentherapie (z. B. stereotaktische Strahlentherapie, Radiochirurgie) reduzieren möglicherweise kurz- und langfristige Nebenwirkungen.
- Strahlendosis
- abhängig von der Strahlenempfindlichkeit des Tumors, z. B.:
- hochmaligne Gliome 60 Gy
- niedrigmaligne Gliome 45–54 Gy
- Medulloblastom 54–55 Gy
- Ependymome mindestens 54 Gy
- Ganzhirnbestrahlung bei Hirmetastasen bis 30 Gy.
- üblicherweise fraktionierte Therapie in Einzeldosen von 1,8–2,0 Gy
- abhängig von der Strahlenempfindlichkeit des Tumors, z. B.:
- Beginn einer postoperativen Strahlentherapie 2–4 Wochen nach der Operation, Dauer ca. 2–7 Wochen
- Nebenwirkungen
- frühe Nebenwirkungen (meistens vorübergehend): Haarausfall, Übelkeit/Erbrechen, Kopfschmerzen, Müdigkeit, Erythem
- späte Nebenwirkungen (meistens anhaltend): Sekundärtumoren, hypothalamische/hypophysäre Insuffizienz, kognitive Störungen, Hörminderung12
Chemotherapie
- Im Vergleich zu früher zunehmende Bedeutung
- Meist systemisch eingesetzt, intratumorale oder intrathekale Applikation nur von untergeordneter Bedeutung
- Chemotherapie ist fester Bestandteil vor allem in der Behandlung von:
- Glioblastomen
- anaplastischen Gliomen
- ZNS-Lymphomen.
- Bei anderen Tumorentitäten Einsatz der Chemotherapie im Kontext der Gesamtsituation und somit letztlich auf individueller Basis
- Die Entscheidung für einen Einsatz der Chemotherapie beruht immer häufiger auf dem molekularen Tumorprofil.
- Eingesetzte Substanzklassen sind:
- klassische Chemotherapeutika (z. B. das Alkylanz Temozolamid)
- Signaltransduktionshemmer (z. B. Imatinib)
- Angiogenesehemmer (z. B. Bevacizumab)
- Immuntherapeutika (z. B. Checkpoint-Inhibitoren)
Glukokortikoide
- Häufig erhebliches Ödem um den Tumor
- Gutes Ansprechen des Ödems auf Glukokortikoide mit deutlicher Linderung der Symptome
- Gabe von Glukokortikoiden auch im Rahmen der präoperativen Vorbereitung
- Aufgrund der erheblichen Nebenwirkungen Gabe über möglichst kurzen Zeitraum
Sonstige Medikamente
- Mannitol-Infusion
- zur Akutbehandlung (Osmotherapie) eines schweren Hirnödems
- Antiepileptika
- Prä- und perioperative antikonvulsive Behandlung bei Patient*innen, die mit Krampfanfällen symptomatisch wurden.
- bevorzugt intravenös applizierbare Substanzen wie Levetiracetam oder Valproinsäure sowie Benzodiazepine
- keine Indikation zur Primärprophylaxe
Neuroepitheliale Tumoren
- Für die verschiedenen Subgruppen von Gliomen bestehen komplexe Therapiealgorithmen abhängig v. a. von histopathologischer und molekulargenetischer Klassifikation.
- Grundprinzipien der Therapie
- größtmögliche, jedoch funktionell nicht einschränkende Resektion
- im Fall von WHO-Grad I auch kurativ13
- bei diffusen WHO-Grad-II- bis -IV-Gliomen primär makroskopisch vollständige Resektion oft möglich, in der Regel aber nicht kurativ (da diffus infiltrierend)
- Das Ausmaß der Resektion hat Auswirkungen auf die Prognose.
- Eine postoperative Strahlentherapie verbessert die Überlebenszeit.
- Die medikamentöse Tumortherapie ist der 3. Pfeiler der Behandlung.
- größtmögliche, jedoch funktionell nicht einschränkende Resektion
- Bei allen Therapieentscheidungen sollten Nutzen und Risiko abgewogen werden vor dem Hintergrund von:
- Alter
- Allgemeinzustand
- neurologischem Zustand.
Neuronale und gemischte neuronal-gliale Tumoren
- Gangliogliome
- Prädilektionsstelle im Temporallappen, häufig medikamentös intraktable Epilepsie
- vollständige Exstirpation im Allgemeinen kurativ
- selten Rezidive
- Zentrale Neurozytome treten definitionsgemäß innerhalb des Ventrikelsystems auf.
- gutartiger Tumor, maligne Transformation äußerst selten
- Ziel ist vollständige Resektion.
- Rezidive sind selten, ggf. Strahlentherapie.
Meningeome
- In der Regel gutartige, gut abgegrenzte Tumoren mit langsamem Wachstum
- Bei kleinen Tumoren ohne Progress und relevante Symptomatik primär nur Verlaufsbeobachtung
- Indikation für Operation
- symptomatische Meningeome
- asymptomatische Tumoren bei progredientem Wachstum
- Ziel der Operation
- komplette Resektion
- bei Meningeomen im Bereich von Sinus sagittalis, Kleinhirnbrückenwinkel, Sinus cavernosus oder Clivus komplette Resektion schwierig oder unmöglich
- komplette Resektion
- Rezidiv
- nach „kompletter“ Resektion 10-Jahres-Rezidivrate 20 %
- bei subtotaler Resektion 10-Jahres-Rezidivrate über 50 %
- Strahlentherapie
- keine Strahlentherapie nach kompletter Resektion von Meningeomen Grad I und II
- nach subtotaler Resektion Verlaufsbeobachtung oder Evaluation einer stereotaktischen Bestrahlung des Resttumors14
- bei anaplastischen/malignen Meningeomen postoperative Strahlentherapie
Vestibularis-Schwannome (früher als Akustikusneurinome bezeichnet)
- Siehe Artikel Vestibularis-Schwannom.
- Bei jüngeren Patient*innen Behandlung
- Bei älteren oder gebrechlichen Patient*innen Abwägung von Risiko und Nutzen
- Therapiealternativen
- chirurgische Resektion und/oder stereotaktische Bestrahlung
- Die Wahl ist abhängig von Tumorgröße, Alter, Gehör (ipsilateral und kontralateral) und Beruf der Betroffenen.
- im Allgemeinen chirurgische Therapie bei Vestibularis-Schwannomen > 3 cm
- stereotaktische Bestrahlung bei Resttumor
- Risiko chirurgischer Komplikationen
- Stereotaktische Bestrahlung
- Alternative zur Operation bei Tumoren < 3 cm
Primäre maligne Lymphome
- Beginn häufig mit multifokalen periventrikulären Läsionen
- systemische Ausbreitung bei ca. 10 % der Patient*innen
- Initiale Behandlung mit Kortikosteroiden
- rascher Rückgang der Läsionen
- Therapie der Wahl: bei Patient*innen < 65 Jahre Chemotherapie auf der Basis von hochdosiertem Methotrexat und hochdosiertem Cytarabin
- 5-Jahres-Überlebensrate 30–40 %
- Bei Patient*innen > 65 Jahre Methotrexat oder Strahlentherapie
- Strahlentherapie mit hohem Risiko für Spätneurotoxizität
Hypophysentumoren
- Therapiemöglichkeiten: Operation, stereotaktische Bestrahlung, medikamentöse Therapie
- Operation in der Regel über transsphenoidalen Zugang durch die Nase (endoskopisch oder mikrochirurgisch)
- In folgenden Fällen Operation als Erstlinientherapie:
- Tumoren (außer Prolaktinome), die eine Kompression neuraler Strukturen verursachen, insbesondere der Sehnerven.
- somatotropinproduzierende Tumoren
- ACTH- und TSH-produzierende Tumoren
- Prolaktinome, die sich bei einer medikamentösen Therapie nicht zurückbilden oder bei denen eine medikamentöse Therapie aufgrund von Nebenwirkungen beendet werden muss.
- In folgenden Fällen medikamentöse Behandlung:
- Erstlinientherapie bei allen Mikroprolaktinomen und den meisten Makroprolaktinomen mit Bromocriptin (Dopaminagonist)
- Supprimierung von Prolaktin und Größenabnahme des Tumors
- bei somatotropinproduzierenden Tumoren Gabe von Somatostatinanaloga (Octreotid), sofern Operation und/oder stereotaktische Bestrahlung ohne zufriedenstellendes Ergebnis
- Ersatztherapie bei Hypopituitarismus
- Erstlinientherapie bei allen Mikroprolaktinomen und den meisten Makroprolaktinomen mit Bromocriptin (Dopaminagonist)
- Strahlentherapie
- Hypophysentumoren sind gegenüber Strahlung relativ empfindlich.
- Stereotaktische Bestrahlung und konventionelle Strahlentherapie sind nützliche Adjuvanzien bei unvollständig entfernten oder infiltrierenden Tumoren.
- Rezidive häufig (10–20 %) – lebenslange Verlaufskontrolle
Metastasen
- Entscheidende Faktoren für die Wahl der Therapie
- Anzahl der Metastasen (durch zerebrale MRT beurteilt)
- Lokalisation und Größe
- Art und Ausbreitung des zugrunde liegenden Tumors
- Allgemeinzustand der Patient*innen
- Bei fortgeschrittener Krebserkrankung und schlechtem Allgemeinzustand sollte von einer spezifischen Behandlung von Hirnmetastasen abgesehen werden.
- Bei wenigen Metastasen kann eine stereotaktische Strahlentherapie in Betracht gezogen werden.
- Glukokortikoide zur Ödembehandlung
- Indikation zur Operation solitärer Hirnmetastasen
- bei ansonsten kontrollierter Tumorerkrankung und relativ gutem Allgemeinzustand
- unbekannter Primärtumor
- Operation der Metastasen
- Verlängert bei den genannten Indikationen die Lebensdauer und verbessert die Lebensqualität.17
- Bei unbekanntem Primärtumor ermöglicht die chirurgische Entfernung eine histologische Untersuchung.
- Stereotaktische Bestrahlung
- Gleichwertig zur Operation bei Metastasen < 3 cm
- Bei Patient*innen mit bis zu 3 Hirnmetastasen ist eine stereotaktische Bestrahlung in einer oder mehreren Sitzungen möglich.
- Postoperative Strahlentherapie
- in der Regel nach Exstirpation der Metastase
- bei regelmäßiger Kontrolle auch abwartendes Prozedere möglich18
- in der Regel nach Exstirpation der Metastase
- Ganzhirnbestrahlung
- bei multiplen Hirnmetastasen
- Chemotherapie
- insgesamt nur von begrenzter Bedeutung
- Option z. B. bei kleinzelligem Bronchial-Ca, Mamma-Ca, Lymphom
- kurativer Ansatz bei Keimzelltumor des Hodens
Palliative Therapie
- Schmerzen
- Übelkeit und Erbrechen
- Verstopfung
- Maligne gastrointestinale Obstruktionen
- Mundtrockenheit
- Mangelernährung und Dehydratation
- Atembeschwerden
- Depression
- Angst
- Delir
Verlauf, Komplikationen und Prognose
Verlauf
- Große Variationsbreite
- Progression kann zwischen Dekaden bei niedriggradigen Tumoren und Tagen bei hochgradig malignen Tumoren variieren.
Anerkennung als Berufskrankheit
- Tritt ein intrakranieller Tumor durch ionisierenden Strahlen im Zusammenhang mit der beruflichen Exposition auf, kann diese Erkrankung als Berufskrankheit anerkannt werden.
- Es wird eine ausführliche Arbeits- und Gefährdungsanamnese erhoben, und ein Gutachten entscheidet über die Anerkennung als Berufskrankheit.
Komplikationen
- Epilepsie
- Depression
- Mentale Veränderungen
Prognose
- Die histologische und molekulargenetische Diagnose ist der wichtigste prognostische Faktor.
- Die Prognose ist ansonsten von Alter und klinischem Zustand der Patient*innen und von der Lokalisation des Tumors abhängig.
- Prognoseschätzungen beziehen sich üblicherweise auf den Zeitpunkt der Diagnosestellung.
- Günstigere Zahlen ergeben sich bei Berücksichtigung der Zeit, die eine Patientin/ein Patient bereits überlebt hat.19
Allgemeine Lebenserwartung
- Relative 5-Jahres-Überlebensraten für Fälle, die in der Zeit von 2007–2011 diagnostiziert wurden.
- nichtmaligne
- Männer: 93,4 %
- Frauen: 95,6 %
- maligne
- Männer: 30,3 %
- Frauen: 33,1 %
- nichtmaligne
- Bei bösartigen Tumoren liegt das mediane Sterbealter bei 67 Jahren (Männer) bzw. 70 Jahren (Frauen).
Gliome
- Die Prognose ist neben dem WHO-Grad vor allem von molekularen Markern abhängig:
- Mutation der IDH (Isozitrat-Dehydrogenase)
- LOH („Loss of Heterozygozity“) von 1p/19q
- Methylierung des Promotors von MGMT-(Methylguanin-Methyltransferase).
Meningeome
- Vollständige OP bei gutartigen Meningeomen meist gleichbedeutend mit Heilung
- Auftreten von Rezidiven abhängig vom WHO-Grad
Hypophysentumoren
- Sowohl hormoninaktive als auch hormonaktive Tumoren in der Regel mit guter Prognose
Vestibularis-Schwannom
- Normale Lebenserwartung nach kompletter Tumorentfernung
ZNS-Lymphome
- Bei jüngeren immunkompetenten Patient*innen Heilung durch Chemotherapie möglich, bei älteren Menschen ungünstigere Prognose
Metastasen
- Unbehandelt medianes Überleben von wenigen Wochen
- Auch unter Therapie sehr schlechte Prognose
- Günstige Faktoren sind Alter, kontrollierter Primärtumor und Abwesenheit extrakranieller Metastasen.
Verlaufskontrolle
- Verlaufskontrolle in der Regel durch Neurolog*in/Neurochirurg*in
- Neben der klinischen Untersuchung ist die MRT in Intervallen die diagnostische Standardmethode für die Bewertung des Krankheitsverlaufs und des Therapieansprechens.
- Im allgemeinen MRT-Intervalle von 3–6 Monaten, je nach Histologie und molekularem Befund aber auch längere Intervalle bei stabilen Krankheitsverläufen und weniger aggressiven Tumoren
- Hormonstatus bei allen Patient*innen, die eine Strahlentherapie durchlaufen haben und bei allen Patient*innen mit Hypophysentumoren.
Patienteninformationen
Patienteninformationen in Deximed
Illustrationen
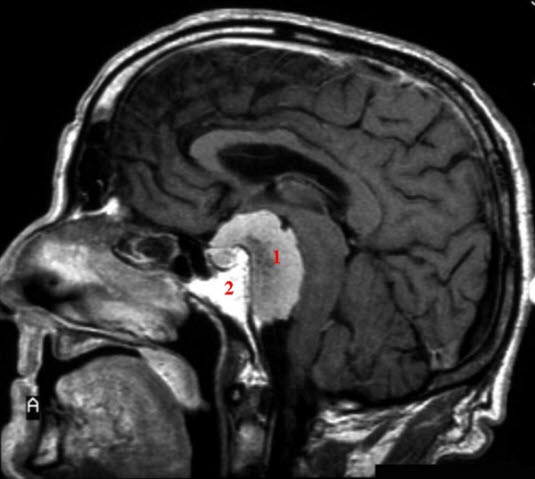
Meningeom, MRT mit Kontrastmittel: Sagittalschnitt. 1. Ödem, 2. Meningeom
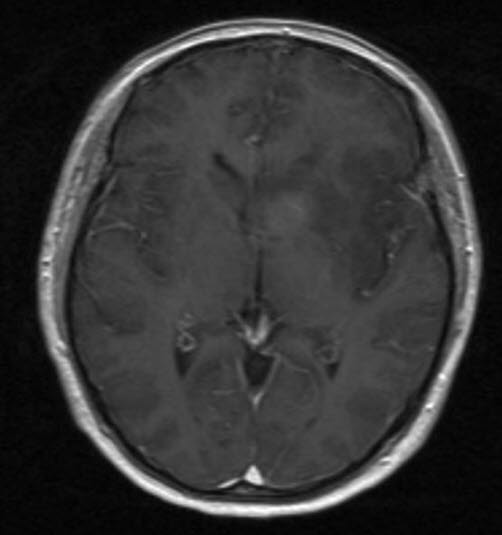
Anaplastisches Astrozytom WHO-Grad III, MRT, axialer Schnitt
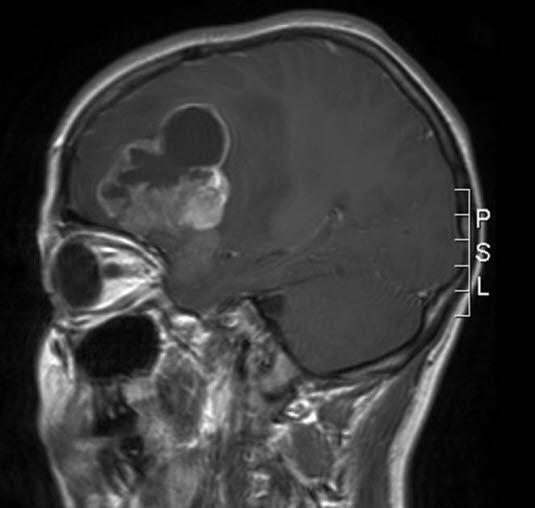
Anaplastisches Ependymom, MRT, Sagittalschnitt
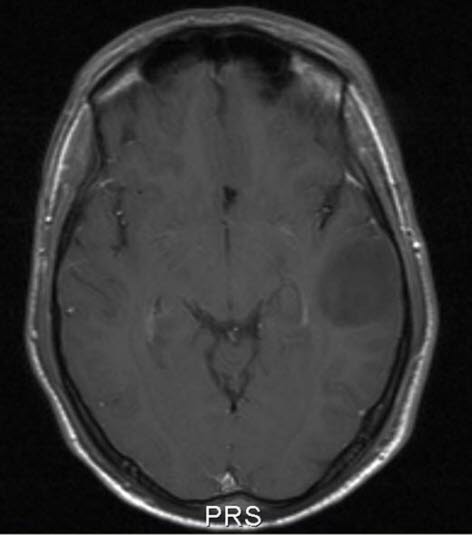
Niedriggradiges Astrozytom WHO-Grad II, axialer Schnitt
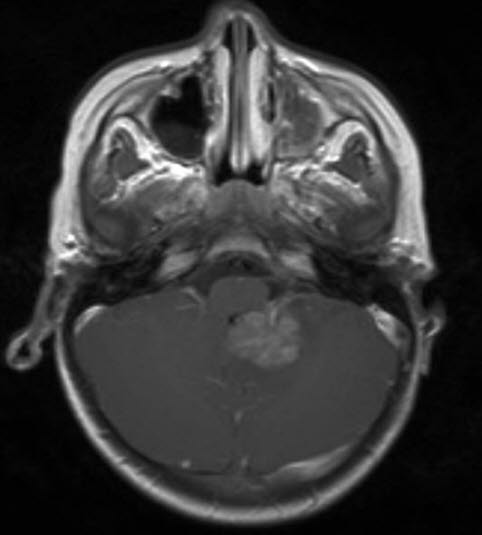
Atypischer teratoider/rhabdoider Tumor, MRT, axialer Schnitt
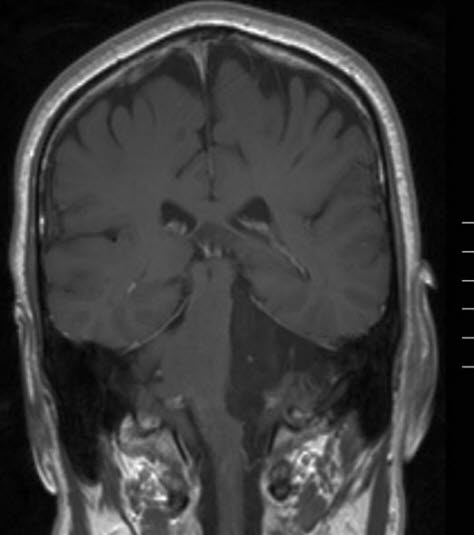
Epidermoidtumor, MRT, koronaler Schnitt
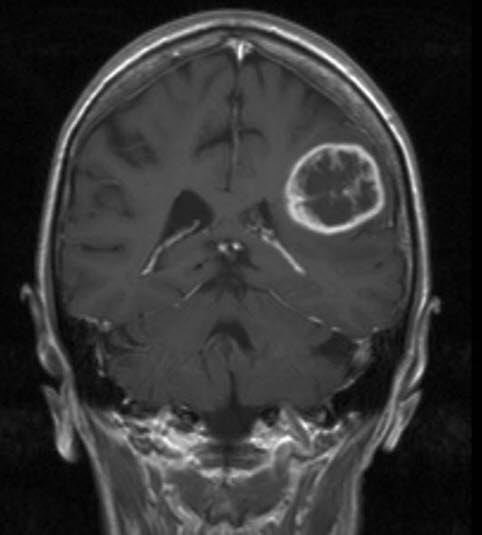
Glioblastom WHO-Grad IV, MRT, koronaler Schnitt
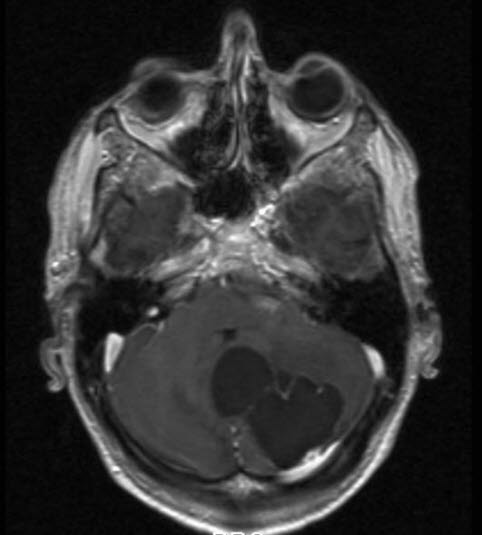
Hämangioblastom, MRT, axialer Schnitt
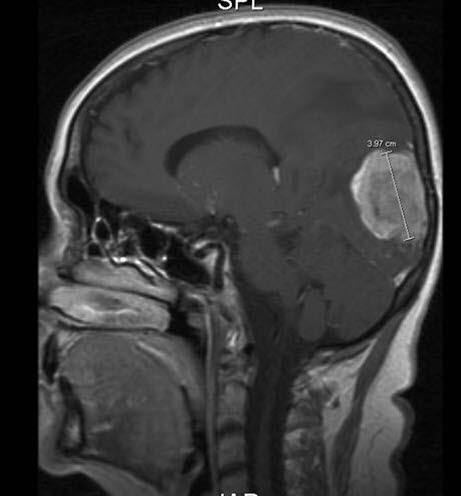
Hirnmetastase durch Brustkrebs, MRT, Sagittalschnitt
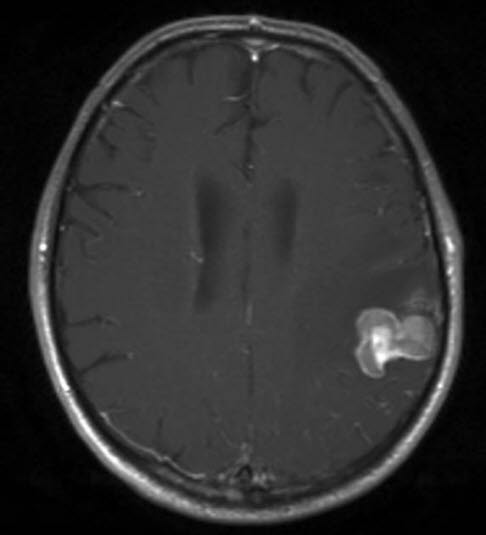
Hirnmetastase durch Nierenkrebs, MRT, axialer Schnitt
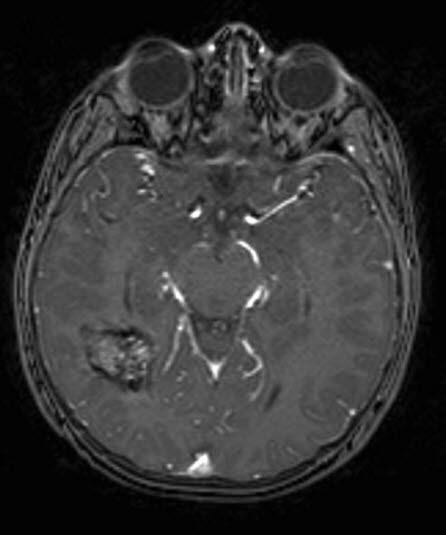
Kavernöses Hämangiom, MRT, axialer Schnitt
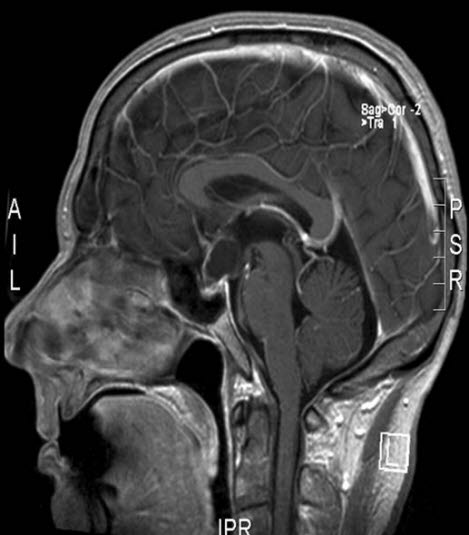
Kraniopharyngeom, MRT, Sagittalschnitt
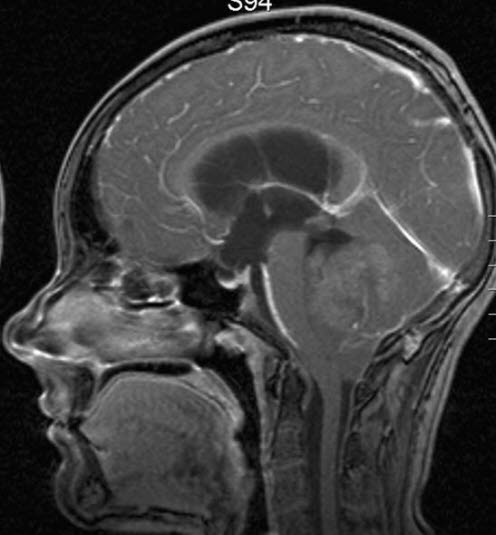
Medulloblastom, MRT, Sagittalschnitt
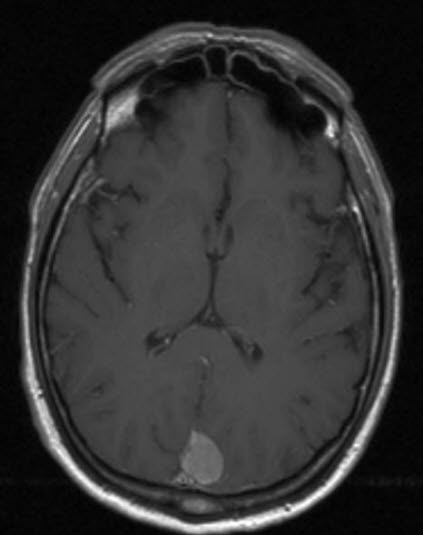
Meningeom, MRT, axialer Schnitt
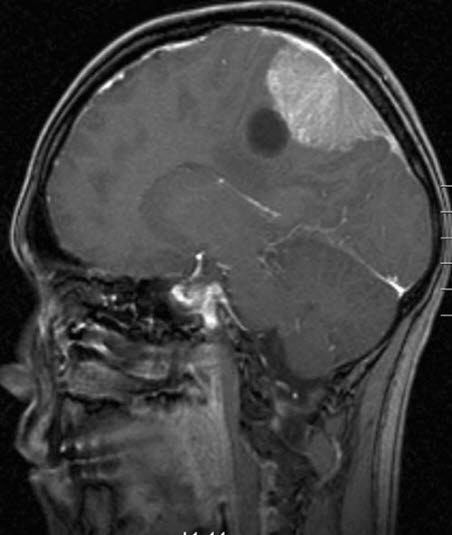
Meningeom mit Zyste, MRT, Sagittalschnitt
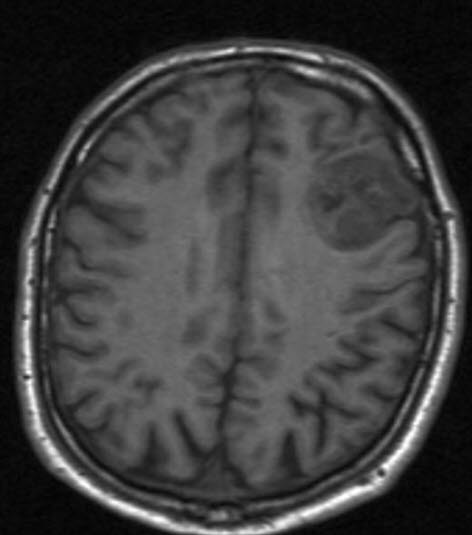
Oligodendrogliom, MRT, axialer Schnitt
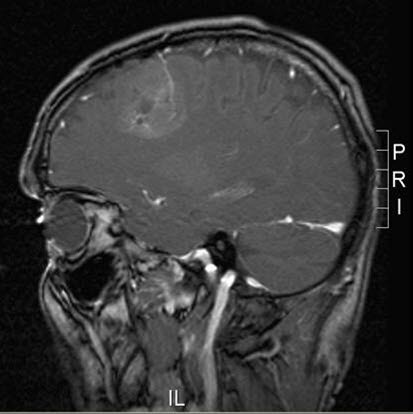
Oligodendrogliom, MRT, Sagittalschnitt
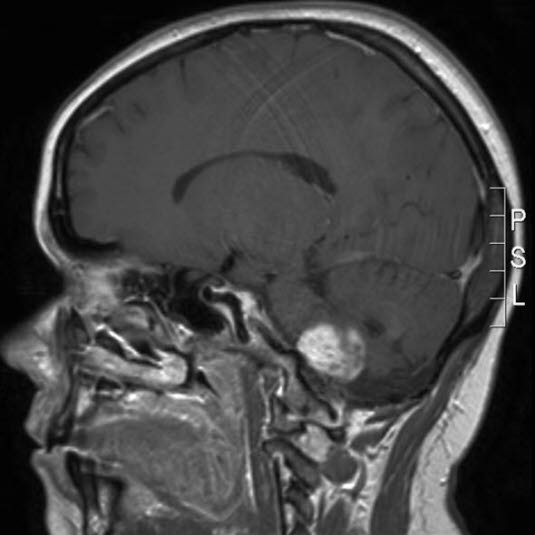
Pilozytisches Astrozytom WHO-Grad I, MRT, Sagittalschnitt
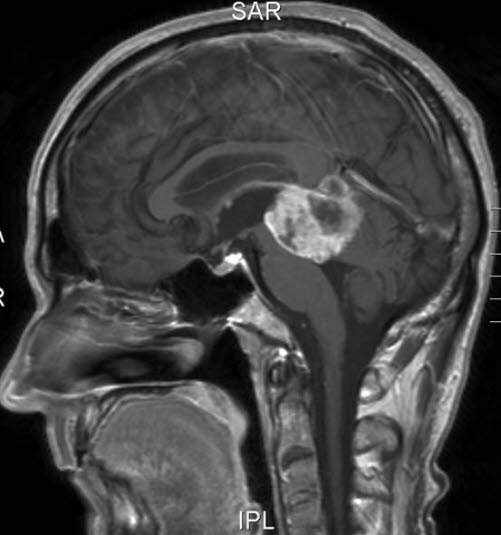
Pinealoblastom, Sagittalschnitt
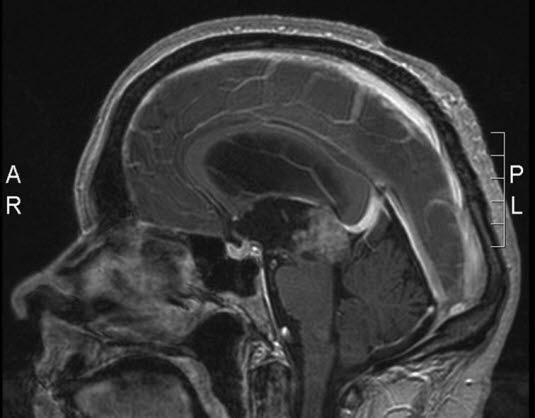
Pineozytom, MRT, Sagittalschnitt
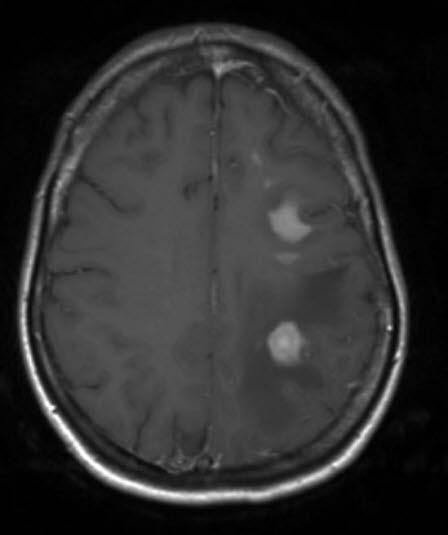
Primäres ZNS-Lymphom, MRT, axialer Schnitt
Quellen
Literatur
- Louis D, Ohgaki H, Wiestler O, et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol 2007; 114: 97-109. www.ncbi.nlm.nih.gov
- Louis D, Perry A, Reifenberger G, et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol 2016; 131: 803-820. doi:10.1007/s00401-016-1545-1 DOI
- Komori T. The 2016 WHO Classification of Tumours of the Central Nervous System: The Major Points of Revision. Neurologia medico-chirurgica 2017; 57: 1-11. doi:10.2176/nmc.ra.2017-0010 DOI
- Schneider T, Mawrin C, Scherlach C, et al. Gliomas in adults. Dtsch Arztebl Int 2010; 107:799–808. DOI: 10.3238/arztebl.2010.0799 www.aerzteblatt.de
- Perkins A, Liu G . Primary Brain Tumors in Adults: Diagnosis and Treatment. Am Fam Physician 2016; 93: 211-217. www.ncbi.nlm.nih.gov
- Saeger W, Lüdecke DK, Buchfelder M, et al. Pathohistological classification of pituitary tumors: 10 years of experience with the German Pituitary Tumor Registry. Eur J Endocrinol 2007; 156: 203-16. pmid:17287410 PubMed
- Whittle IR, Smith C, Navoo P, Collie D. Meningiomas. Lancet 2004; 363: 1535-43. www.ncbi.nlm.nih.gov
- Wiemels J, Wrensch M, Claus EB. Epidemiology and etiology of meningioma. J Neurooncol 2010; 99: 307-14. pmid:20821343 PubMed
- Corn BW, Marcus SM, Topham A, Hauck W, Curran WJ jr. Will primary central nervous system lymphoma be the most frequent brain tumor diagnosed in the year 2000? Cancer 1997; 79: 2409 - 13. PubMed
- Trichopoulos D, Adami H-O. Cellular telephones and brain tumors. N Engl J Med 2001; 344: 133-4. PubMed
- Wen PY, Schiff D, Kesari S, Drappatz J, Gigas D, Doherty L. Medical management of patients with brain tumors. J Neurooncol 2006; 80: 313-32. PubMed
- Rauhut F, Stolke D. Combined surgery and radiotherapy of invasive pituitary adenomas - problems of radiogenic encephalopathy. Acta Neurochir (Wien) 1996; 65: 3-40. www.ncbi.nlm.nih.gov
- Jakola AS, Myrmel KS, Kloster R, et al. Comparison of a strategy favoring early surgical resection vs a strategy favoring watchful waiting in low-grade gliomas. JAMA 2012; 308: 1881-8. pmid:23099483 PubMed
- Debus J, Wuendrich M, Pirzkall A, Hoess A, Schlegel W, Zuna I et al. High efficacy of fractionated stereotactic radiotherapy of large base-of-skull meningiomas: long-term results. J Clin Oncol 2001; 19: 3547 - 53. PubMed
- Samii M, Matthies C. Management of 1000 vestibular schwannomas (acustic neuromas): the facial nerve - preservation and restitution of function. Neurosurg 1997; 40: 684-95. www.ncbi.nlm.nih.gov
- Matthies C, Samii M. Management of vestibular schwannomas (acustic neuromas): the value of neurophysiology for evaluation and prediction of auditory function in 420 cases. Neurosurg 1997; 40: 919-30. www.ncbi.nlm.nih.gov
- Patchell RA, Tibbs PA, Walsh JW, Dempsey RJ, Maruyama Y, Kryscio RJ et al. A randomized trial of surgery in the treatment of single metastases to the brain. N Engl J Med 1990; 322: 494 - 500. New England Journal of Medicine
- Mekhail T, Sombeck M, Sollaccio R. Adjuvant whole-brain radiotherapy versus observation after radiosurgery or surgical resection of one to three cerebral metastases: results of the EORTC 22952-26001 study. Curr Oncol Rep 2011; 13: 255-8. pmid:21584645 PubMed
- Porter KR, McCarthy BJ, Berbaum ML, Davis FG. Conditional survival of all primary brain tumor patients by age, behavior, and histology. Neuroepidemiology 2011; 36: 230-9. pmid:21677447 PubMed
Autor*innen
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i. Br.