Informacje ogólne
Definicja
- Definicja zawału mięśnia sercowego według ESC/ACC/AHA/WHF Task Force for the Universal Definition of Myocardial Infarction1
- ostry zawał mięśnia sercowego
- stwierdzenie martwicy mięśnia sercowego (wzrost poziomu troponiny) przy obrazie klinicznym ostrego niedokrwienia mięśnia sercowego
- przebyty zawał mięśnia sercowego
- obecność patologicznych załamków Q z objawami lub bez objawów przy braku przyczyn innych niż niedokrwienne
uwidocznienieUwidocznienie ubytku żywotnegoywego mięśnia sercowego w badaniach obrazowych, którego obraz odpowiada etiologii niedokrwiennej.
- ostry zawał mięśnia sercowego
Klasyfikacja zawału mięśnia sercowego na podstawie wyników EKG
- Podział przypadków ostrego zawału mięśnia sercowego na dwie grupy na podstawie wyników EKG:
- zawał z uniesieniem odcinka ST lub STEMI (ST Elevation Myocardial Infarction)
- zazwyczaj spowodowany całkowitą zakrzepową niedrożnością naczynia2
- zawał bez uniesienia odcinka ST lub NSTEMI (Non ST Elevation Myocardial Infarction)
- spowodowany częściową niedrożnością naczynia lub całkowitą niedrożnością z krążeniem obocznym2
- zawał z uniesieniem odcinka ST lub STEMI (ST Elevation Myocardial Infarction)
Epidemiologia
- Choroby układu krążenia są najczęstszą przyczyną zgonów w krajach uprzemysłowionych, ale także w krajach rozwijających się.
- Częstość występowania zawału mięśnia sercowego w ciągu całego życia wynosi
ok.około 5 - Wzrost częstości występowania zawału mięśnia sercowego wraz z wiekiem z 1–2% u osób w wieku 40–49 lat do
ok.około 10% u osób w wieku 70–79 lat. Skorygowana o wiek częstość występowania zawału mięśnia sercowego z roku na rok maleje, zwłaszcza u mężczyzn. - Rocznie w Polsce hospitalizowanych jest około 90 tysięcy chorych z zawałami serca – z uniesieniem odcinka ST (STEMI) (ok. 1/3) i bez uniesienia odcinka ST (NSTEMI) (ok. 2/3).3
- W USA i Europie współczynnik umieralności spada od połowy lat 90. XX wieku.
34. - W krajach rozwijających się spodziewany jest gwałtowny wzrost śmiertelności z powodu chorób sercowo-naczyniowych.
45. - Częstość występowania zawału mięśnia sercowego jest odwrotnie zależna od mediany dochodu w danym kraju (odpowiednio 1,92/2,21/4,13 przypadków na 1000 osobo-lat w krajach o wysokim/średnim/niskim dochodzie).2
. - Ponad 80% wszystkich zgonów z powodu chorób układu krążenia ma obecnie miejsce w krajach rozwijających się.2
.
Etiologia
Miażdżyca
SąJest przyczynąok.około 90% zawałów.45.- Czynnikiem wyzwalającym jest pęknięcie blaszki miażdżycowej z wytworzeniem skrzepliny.
UwagaUWAGA: decydującymizmiennymiczynnikami wystąpienia zawału są skład i podatność blaszki miażdżycowej, a nie jej wielkość czy stopień zwężenia!56!- Wysokotłuszczowe, miękkie blaszki są bardziej niebezpieczne niż blaszki twarde, ponieważ łatwiej pękają i mają większy potencjał trombogenny po pęknięciu.
56.
- Wysokotłuszczowe, miękkie blaszki są bardziej niebezpieczne niż blaszki twarde, ponieważ łatwiej pękają i mają większy potencjał trombogenny po pęknięciu.
Zator
- Czynnik sprawczy
ok.około 3% ostrych zawałów67 - Najczęstszą przyczyną jest migotanie przedsionków, inne przyczyny to kardiomiopatie, choroby zastawek, infekcyjne zapalenie wsierdzia, nowotwory złośliwe i zator skrzyżowany z powodu przetrwałego otworu owalnego (patent foramen
ovaleovale — PFO)/ubytku przegrody międzyprzedsionkowej (atrial septal defect — ASD).67.
Skurcz
- Niedrożność/zamknięcie naczynia spowodowane przez nadreaktywne komórki mięśni gładkich i dysfunkcję śródbłonka
78 SkurczeSkurczsąjestodpowiedzialneodpowiedzialny zaok.około 1–1,5% przyjęć do szpitala z powodu dławicy piersiowej.
Inne przyczyny
- Rzadsze przyczyny to zapalenia naczyń, rozwarstwienia aorty, narkotyki, anomalie wieńcowe, urazy
45
Patogeneza
- Najczęściej proces patofizjologiczny rozpoczyna się od pęknięcia niestabilnej blaszki miażdżycowej z wytworzeniem skrzepliny.
- Niedrożność naczynia, a tym samym brak równowagi między zapotrzebowaniem mięśnia sercowego na tlen a jego podażą w obszarze zaopatrzenia niedrożnego naczynia
- Kaskada zmian biochemicznych i komórkowych prowadzi do szybkiego upośledzenia czynności mięśnia sercowego, a w dalszym przebiegu ostatecznie do martwicy
jego tkanki. - Znaczne zaburzenia ruchomości ścian mogą wystąpić już po 60 sekundach.
45. - Nieodwracalne uszkodzenie mięśnia sercowego
wystnastępuje od 20 minut do kilku godzin od początku zaburzeń perfuzji.45. FaloweStrefaprzemieszczaniezawału przemieszcza sięstrefy zawałufalowo od wnętrza serca do nasierdzia i do stref granicznych obszaru zagrożonego zawałem („Areaarea atRiskrisk”).89- Rozległość zawału zależy od
:89:- wielkości obszaru niedokrwienia
- czasu trwania (i ewentualnie okresowego ustępowania) niedrożności naczynia wieńcowego
- obecności krążenia obocznego
- stopnia dysfunkcji mikronaczyniowej
- Reperfuzja jest konieczna, aby uratować niedokrwiony mięsień sercowy i ograniczyć strefę zawału.
- Z drugiej strony nie tylko niedokrwienie, ale i reperfuzja per se paradoksalnie prowadzi do nasilenia uszkodzenia mięśnia sercowego i zaburzeń krążenia.
89. - Testowano różne mechaniczne i farmakologiczne strategie ograniczania uszkodzenia reperfuzyjnego, ale nie udało się jeszcze przełożyć badań eksperymentalnych ani proof-of-concept na praktykę kliniczną.
89. PowstanieW dalszym przebiegu dochodzi do powstania martwicy skrzepowej (denaturacyjnej) z bliznowaceniemw dalszym przebiegu.EwentualnieNastępnierozszerzeniedochodzi do ewentualnego rozszerzenia izmianazmiany kształtu komory w procesie gojenia, tzw. „remodeling”
Przewlekłe czynniki ryzyka
- Zobacz także artykuł Pierwotna profilaktyka chorób układu krążenia.
Modyfikowalne czynniki ryzyka
- W badaniu INTERHEART zidentyfikowano potencjalnie modyfikowalne czynniki predysponujące do wystąpienia zawału mięśnia sercowego.
910.- wzrost ryzyka z powodu:
- palenia papierosów
- cukrzycy
- nadciśnienia tętniczego
- otyłości brzusznej (stosunek obwodu talii do obwodu bioder)
- zwiększonego stosunku apoB/apoA1
- stresu psychospołecznego
- obniżenie ryzyka poprzez:
- codzienne spożywanie owoców i warzyw
- aktywność fizyczną
- ewentualnie umiarkowane spożywanie alkoholu
- wzrost ryzyka z powodu:
Niemodyfikowalne czynniki ryzyka
- Wiek
- Płeć
- Wywiad rodzinny
- Wzrost ryzyka wynikający z dodatniego wywiadu rodzinnego związany jest z
1213:liczbLiczbą osób spokrewnionych, u których wystąpił zawał.wiekiemWiekiem, w którym wystąpił zawał u osób spokrewnionych (odwrotna zależność: im młodszy wiek, w którym zawał wystąpił u osoby spokrewnionej, tym większe ryzyko).
- Wzrost ryzyka wynikający z dodatniego wywiadu rodzinnego związany jest z
Ostre czynniki ryzyka wystąpienia zawału mięśnia sercowego
- Ostre czynniki ryzyka to czynności lub okoliczności, które krótkotrwale i przejściowo mogą zwiększać ryzyko wystąpienia ostrego zawału mięśnia sercowego
1314:- rytm okołodobowy: zwiększone ryzyko w godzinach porannych
- wysiłek fizyczny
- stres psychiczny
- ekspozycja na zimno
- aktywność seksualna
- spożycie dużej ilości alkoholu
- kawa
- kokaina
nadmiernenadmierniejedzenieobfite posiłki
Inne czynniki ryzyka
- Inne czynniki mogą zwiększyć ryzyko, w tym:
- reumatoidalne zapalenie stawów i inne choroby reumatologiczne
1415 - ciężka łuszczyca
1516 - stosowanie NLPZ u pacjentów z chorobą wieńcową
1617-1718 - wysokie tętno spoczynkowe
1819 - zakaż
eniaeniegrypąwirusem grypy1920
- reumatoidalne zapalenie stawów i inne choroby reumatologiczne
ICD-10
- I21 Ostry zawał mięśnia sercowego
- I21.0 Ostry zawał serca pełnościenny ściany przedniej
- I21.1 Ostry zawał serca pełnościenny ściany dolnej
- I21.2 Ostry zawał serca pełnościenny o innej lokalizacji
- I21.3 Ostry zawał serca pełnościenny o nieokreślonym umiejscowieniu
- I21.4 Ostry zawał serca podwsierdziowy
- I21.9 Ostry zawał serca, nieokreślony
- I22 Ponowny zawał serca
- I22.0 Ponowny zawał serca ściany przedniej
- I22.1 Ponowny ostry zawał serca ściany dolnej
- I22.8 Ponowny ostry zawał serca o innej lokalizacji
- I22.9 Ponowny ostry zawał serca o nieokreślonym umiejscowieniu
- I23 Niektóre powikłania występujące w czasie ostrego zawału mięśnia sercowego
- I23.0 Krwiak osierdzia jako powikłanie występujące w czasie ostrego zawału serca
- I23.1 Ubytek przegrody międzyprzedsionkowej jako powikłanie występujące w czasie ostrego zawału serca
- I23.2 Ubytek przegrody międzykomorowej jako powikłanie występujące w czasie ostrego zawału serca
- I23.3 Pęknięcie ściany serca bez krwiaka osierdzia jako powikłanie występujące w czasie ostrego zawału serca
- I23.4 Pęknięcie strun ścięgnistych jako powikłanie występujące w czasie ostrego zawału serca
- I23.5 Pęknięcie mięśnia brodawkowatego jako powikłanie występujące w czasie ostrego zawału serca
- I23.6 Skrzeplina w przedsionku, uszku przedsionka i komorze jako powikłanie występujące w czasie ostrego zawału serca
- I23.8 Inne powikłania występujące w czasie ostrego zawału mięśnia sercowego
- I25 Przewlekła choroba niedokrwienna serca
- I25.2 Przebyty zawał serca
Diagnostyka
Kryteria diagnostyczne
- Zawał mięśnia sercowego można pod względem patogenetycznym i klinicznym podzielić na pięć typów1:
- Typ 1: zawał mięśnia sercowego na tle choroby wieńcowej, zwykle wywołany pęknięciem blaszki miażdżycowej z całkowitą lub niepełną zakrzepową niedrożnością naczynia
- wzrost i/lub spadek troponiny z co najmniej jedną wartością powyżej normy i co najmniej jednym z następujących kryteriów:
- objawy niedokrwienia
- nowe zmiany w EKG o charakterze niedokrwiennym
- uwidocznienie patologicznych załamków Q w EKG
- diagnostyka obrazowa: nowe zaburzenia ruchomości ściany lub ubytek żywotnego mięśnia sercowego
- stwierdzenie skrzepliny wewnątrzwieńcowej
- wzrost i/lub spadek troponiny z co najmniej jedną wartością powyżej normy i co najmniej jednym z następujących kryteriów:
- Typ 2: zawał mięśnia sercowego spowodowany brakiem równowagi między zapotrzebowaniem na tlen a zaopatrzeniem tkanek mięśnia sercowego w tlen, z definicji niespowodowany pęknięciem blaszki miażdżycowej (czynniki wyzwalające, np. niedociśnienie, niedokrwistość, tachyarytmia lub bradyarytmia, zator, skurcz)
- wzrost poziomu troponiny i inne kryteria jak w typie 1 (z wyjątkiem stwierdzenia skrzepliny)
- Typ 3: zgon sercowy z objawami i zmianami EKG świadczącymi o niedokrwieniu, zgon przed możliwością pobrania krwi lub przed wzrostem stężenia troponiny lub wykrycie zawału w sekcji zwłok
- Typ 4: zawał mięśnia sercowego w związku z przezskórną interwencją wieńcową (PCI)
- wzrost stężenia troponiny do poziomu przekraczającego pięciokrotność górnej granicy normy wraz z uwidocznieniem zmian niedokrwiennych w EKG lub zmian w angiografii/obrazowaniu mięśnia sercowego
- Typ 5: zawał mięśnia sercowego w związku z operacją wszczepienia bypassów (CABG)
- wzrost stężenia troponiny do poziomu przekraczającego dziesięciokrotność górnej granicy normy wraz z uwidocznieniem zmian niedokrwiennych w EKG lub zmian w angiografii/obrazowaniu mięśnia sercowego
Diagnostyka różnicowa
Schorzenia sercowo-naczyniowe
- Niestabilna dławica piersiowa (angina pectoris): ostry zespół wieńcowy (OZW) bez wzrostu troponiny
- Zatorowość płucna
- Zapalenie osierdzia (pericarditis)
- Kardiomiopatia stresowa (takotsubo)
- Tętniak aorty
- Rozwarstwienie aorty
- Zapalenie mięśnia sercowego (myocarditis)
- Zwężenie zastawki aortalnej (stenoza aortalna)
Inne choroby
- Płuca
- Przewód pokarmowy
- Ściana klatki piersiowej
- zespół ściany klatki piersiowej (zespół Tietza)
- półpasiec
- złamanie żebra
- przerzuty do kości
- nerwoból
- Zaburzenia lękowe
- Zaburzenia depresyjne
- Zespół Da Costy („nerwica serca”)
Wywiad lekarski
Możliwe objawy prodromalne
- Objawy prodromalne mogą wystąpić przed właściwym OZW u obu płci, częściej u kobiet
2021-2122:- osłabienie
- zaburzenia snu
- stany lękowe
- duszność
- łagodne dolegliwości w klatce piersiowej/dyskomfort w
ręcekończynie górnej
Aktualny wywiad lekarski
- Ból w klatce piersiowej
- główny objaw u 70% mężczyzn, ale tylko u 50% kobiet
2223 - typowy ból w klatce piersiowej ("stenokardialny")
2324:- silny
- piekący, dławiący, gniotący lub ściskający
- występuje nagle
- lewostronny
- wyzwolony/nasilony przez wysiłek
- towarzyszą mu
zadyszkaduszność, lęk
- możliwe promieniowanie do ramienia (ramion), szyi,
dolnej szczękiżuchwy, nadbrzusza, barków - Poprawa po podaniu azotanów (nitrogliceryna) nie jest swoista dla niedokrwienia.
2425.
- główny objaw u 70% mężczyzn, ale tylko u 50% kobiet
- Duszność, niekiedy z towarzyszącym kaszlem
- Nudności
- Lęk, niepokój
- Kołatanie serca
- Zawroty głowy
- Atypowe dolegliwości (np. izolowana duszność, dolegliwości podobne do dyspepsji) występują częściej:
- u kobiet
- u osób starszych
- w cukrzycy
- w niewydolności nerek
- w otępieniu
- „Typowe” objawy nie stanowią potwierdzenia zawału, „nietypowe” go nie wykluczają!
2324!
Wcześniejsze występowanie w wywiadzie
- Czynniki ryzyka sercowo-naczyniowego, w tym wywiad rodzinny
- Rozpoznana wcześniej choroba wieńcowa, stan po zawale mięśnia sercowego
- Inne choroby sercowo-naczyniowe
- Leki
Badanie przedmiotowe
Ocena
- Ogólny stan fizyczny
- Lęk?
- Zaburzenia świadomości?
- Bladość, sinica?
- Zimne poty?
- Tachypnoe?
- Poszerzenie żył szyjnych?
Parametry życiowe
- Tętno
- czę
stotliwostość - arytmia
- czę
- Ciśnienie tętnicze
- Może być prawidłowe, podwyższone lub obniżone.
- W szczególności świeżo występujące niedociśnienie (hipotonia) może świadczyć o wstrząsie kardiogennym.
- Saturacja
O2O2 - Temperatura ciała
- często wzrost temperatury w ciągu pierwszych 24–48 godzin
45
- często wzrost temperatury w ciągu pierwszych 24–48 godzin
Osłuchiwanie
- Badanie osłuchowe często w normie
- Możliwa tachykardia lub bradykardia
- Ewentualnie trzeci ton serca
- Ewentualnie szmer skurczowy przy niedomykalności zastawki mitralnej lub pęknięciu przegrody międzykomorowej
- Zobacz również artykuł Szmery nad sercem u dorosłych.
- Możliwe trzeszczenia nad płucami przy zastoju w krążeniu płucnym
Postępowanie diagnostyczne lekarza rodzinnego w przypadku bólu w klatce piersiowej
- Ocena wstępna: czy istnieje zagrożenie dla życia pacjenta?
- Ocena prawdopodobieństwa choroby wieńcowej/OZW
- Ewentualnie wyjaśnienie przyczyn
niesercowychpozasercowych
Ocena wstępna: zagrożenie życia?
- Wstępna ocena sytuacji opiera się na:
- okoliczności konsultacji
- pilna wizyta domowa
- zaniepokojenie rodziny
- pierwsze wrażenie dotyczące stanu chorego
- ukierunkowany wywiad lekarski/badanie dodatkowe
- (bezpośrednio poprzedzające) omdlenie albo
zapaśćzasłabnięcie - zimne poty
- objawy hemodynamiczne niewydolności krążenia (wskaźnik wstrząsowy = stosunek częstości tętna do ciśnienia skurczowego >1)
- (bezpośrednio poprzedzające) omdlenie albo
- okoliczności konsultacji
- W razie potrzeby należy udzielić pierwszej pomocy lub podjąć działania ratujące życie.
Natychmiastowenatychmiastowe działania ratujące życie i terapia objawowa, zobacz także artykuły:- monitorowanie w zależności od dostępnych możliwości
- zaalarmowanie służb ratowniczych — skierowanie do szpitala
- W miarę możliwości EKG.
PrawidJednak prawidłoweowy zapis EKGnie powinno jednakw żadnym wypadkuprzesądzanie powinien oznaczać, że nie należy pilnie skierowaćo odstąpieniu od przyjęciapacjenta do szpitalaw trybie pilnymw obecności ratownika medycznego, jeśli istniejewrażeniepodejrzenie, że pacjentprzechodzima zawałmięśnia sercowegoserca. dalszeprowadzeniekrokidalszychdiagnostycznedziałań diagnostycznych w miarę możliwościwdanej sytuacji
Ocena prawdopodobieństwa choroby wieńcowej/OZW: ocena prawdopodobieństwa choroby wieńcowej
- Jeżeli parametry życiowe
niesąnieprawidprawidłowew bezpośredniejnależyocenie, dokonuje siędokonać oceny prawdopodobieństwawystąpieniachoroby wieńcowej/OZW jako najczęstszej przyczyny niebezpiecznego przebiegu, któremu można zapobiec. - Prostym narzędziem oceny prawdopodobieństwa choroby wieńcowej jest skala Marburg Heart Score, która została opracowana dla lekarzy rodzinnych.
- Ocenia się 5 kryteriów (po 1 punkcie za każde kryterium):
- wiek/płeć (mężczyźni ≥55 lat i kobiety ≥65 lat)
- znana choroba naczyniowa
dolegliwościnarastaniepodczasbólu przy wysiłkubBólelpalpacyjnenieniemożliwejestdowywołanyodtworzeniapodczas palpacji klatki piersiowej.pacjentPacjent podejrzewa, że przyczyną jest choroba serca.
- Prawdopodobieństwo choroby wieńcowej:
- 0–1 punkt: bardzo niskie (<1%)
> - 2 punkty: niskie
:(5 - 3 punkty: średnie: (25
- 4–5 punktów: wysokie (65%)
- 0–1 punkt: bardzo niskie (<1%)
Ocena
Tabela 1. prawdopodobieństwo choroby wieńcowej - zmodyfikowana klasyfikacja Diamonda-Forrestera, na podstawie wytycznych ESC 2019 r. i Interna Szczeklika 2022 r.
| Wiek (lata) | 30-39 | 40-49 | 50-59 | 60-69 | ≥70 |
| Płeć | M K | M K | M K | M K | M K |
| Typowa dławica piersiowa | m m | d u | d u | d d | d d |
| Atypowa dławica piersiowa | m m | u u | d u | d u | d d |
| Ból niedławicowy | m m | m m | u m | d u | d u |
|
K - kobiety; M - mężczyźni Prawdopodobieństwo : m - małe <5% (badania dodatkowe tylko w szczególnych przypadkach); u - umiarkowane 5 - 15% (badania dodatkowe można rozważyć); d - duże > 15% (preferowane wykonanie badań dodatkowych) |
|||||
Ocena prawdopodobieństwa wystąpienia ostrego zespołu wieńcowego (OZW)
- Pacjentów z pośrednim lub wysokim prawdopodobieństwem
wystąpieniachoroby wieńcowej (Marburg Heart Score >2 punkty) należy ocenić pod kątem prawdopodobieństwawystąpieniaOZW. - Kryteria, które przemawiają za OZW:
- niedawne wystąpienie dolegliwości w spoczynku
- czas trwania dolegliwości w spoczynku >20 minut
- dławica piersiowa narastająca ("crescendo angina")
pacjentPacjent czuje się inaczej niż zwykle.zaniepokojenie stanemniepokój pacjenta- zimne poty
- bladość
- Kryteria, które przemawiają przeciwko OZW:
- Ból w klatce piersiowej nie jest faktycznym powodem konsultacji.
Badania uzupełniające
- Decydującymi badaniami dodatkowymi potwierdzającymi wstępne rozpoznanie w przypadku klinicznego podejrzenia OZW są: EKG oraz wyniki
testówbadań laboratoryjnych(- troponina sercowa (w Polsce nie jest badaniem wykonywanym w POZ).
EKG
- EKG 12-odprowadzeniowe należy wykonać jak najszybciej w przypadku podejrzenia OZW. Jeśli jednak prawdopodobieństwo OZW przed badaniem jest wysokie, prawidłowe EKG nie powinno przesądzać o zaniechaniu dalszych działań — odsetek fałszywie ujemnych wyników EKG jest wysoki.
- Należy przeanalizować EKG pod kątem (zobacz również EKG — lista kontrolna):
- zmiany w odcinku ST-T
- utrzymujące się uniesienia odcinka ST
- obniżenie odcinka ST
- ujemne załamki T
- załamki Q
- przebyty zawał mięśnia sercowego lub już zaawansowany ostry zawał mięśnia sercowego
- inne możliwe zmiany w EKG
- blok odnogi pęczka Hisa
- częstoskurcze komorowe/skurcze dodatkowe
skurcze - częstoskurcze nadkomorowe/skurcze dodatkowe
skurcze - bloki przedsionkowo-komorowe, bloki SA (zatokowo-przedsionkowe)
- Ewentualnie wykonać EKG z dodatkowymi odprowadzeniami, aby
wychwycirozpoznać zawał boczny (odpr. V7-V9) lub prawokomorowy (odpr. V3R–V4R). - arytmie — np. wystąpienie po raz pierwszy migotania przedsionków
- zmiany w odcinku ST-T
- U objawowych pacjentów z początkowo niediagnostycznym EKG należy wykonać
seryjnekolejne badania EKG. - W miarę możliwości porównanie z poprzednimi zapisami EKG
Objawy ostrego niedokrwienia mięśnia sercowego w badaniu EKG1
- Uniesienie odcinka ST
- Wystąpienie po raz pierwszy uniesienia odcinka ST w punkcie J w 2 kolejnych odprowadzeniach należy uznać za istotne:
- we wszystkich odprowadzeniach oprócz V2–V3: ≥0,1 mV
- odprowadzenia V2–V3: ≥0,2 mV u mężczyzn ≥40.
r.roku ż.;ycia, ≥0,2515 mV umężczyznkobiet26
- Wystąpienie po raz pierwszy uniesienia odcinka ST w punkcie J w 2 kolejnych odprowadzeniach należy uznać za istotne:
- Obniżenia odcinka ST i zmiany załamka T
- wystąpienie po raz pierwszy poziomego lub zstępującego obniżenia odcinka ST ≥0,05 mV w dwóch kolejnych odprowadzeniach i/lub ujemny załamek T ≥0,1 mV w dwóch kolejnych odprowadzeniach z wyraźnym załamkiem R lub R/S >1
Objawy przebytego zawału mięśnia sercowego w badaniu EKG1
- Załamek Q w odprowadzeniach V2–V3 ≥0,02 s lub zespół QS w odprowadzeniach V2 i V3
- Załamek Q ≥0,03 s i ≥0,1 mV lub zespół QS w odprowadzeniach I, II, aVL, aVF lub V4–V6 w dwóch odprowadzeniach
- Załamek R ≥0,04 s w odprowadzeniach V1–V2 i R/S ≥1 ze zgodnym dodatnim załamkiem T (jeśli nie ma zaburzeń przewodzenia)
Troponina
- Obecnie w ocenie uszkodzenia mięśnia sercowego dominują oznaczenia troponiny sercowej (I lub T).
- Sercowe troponiny I i T ulegają ekspresji niemal wyłącznie w mięśniu sercowym.
Natomiast oznaczenieOznaczanie CK MBPodwyższenieWzroststężeniapoziomu troponiny wskazuje na uszkodzenie mięśnia sercowego, ale samo w sobie nie wskazuje, jaki mechanizm leży u jego podstaw.1.PodwyższenieWzroststężeniapoziomu troponiny definiuje się jako wartość powyżej 99 percentyla dla ogólnej populacji.1.- Wzrost po 1–3 godzinach, szczyt po 12–96 godzinach, normalizacja w ciągu 1-2 tygodni
- Preferowane oznaczanie przy użyciu wysokoczułych testów troponinowych ("high sensitivity")
2527- wysoka negatywna wartość predykcyjna
- krótszy interwał „nieczuły na troponinę”, wzrost
ok.około 1 godziny po wystąpieniu objawów w przypadku stosowania wysokoczułych testów na troponinę - W izbie przyjęć/
- interpretacja jako marker ilościowy (nie tylko „dodatni” lub „ujemny”)
- Im wyższa wartość pomiarowa, tym większe prawdopodobieństwo, że przyczyną jest zawał mięśnia sercowego.
- Testy point-of-care (szybkie testy troponinowe, wykonywane w miejscu opieki nad pacjentem) w praktyce lekarza rodzinnego są przydatne tylko wtedy, gdy uwzględni się ich ograniczenia.
- niższa
wrażliwoczułość - niższa ujemna wartość predykcyjna
- Należy uwzględnić kilkugodzinny okres opóźnienia do wystąpienia wzrostu troponiny. Jeśli test troponinowy został wykonany wcześniej, należy go powtórzyć,
jeśligdy występują odpowiednie objawy kliniczne. Ujemny wynik testu troponinowego w żadnym przypadku nie powinienprzesądzaoznaczać,o zaniechaniużedalszychdalsze działańania nie są konieczne,stosownetypowe objawy kliniczne.- W miastach z dobrze rozwiniętym systemem ratownictwa medycznego oznaczanie troponiny wydaje się zwykle zbędne. Jeśli odległość do najbliższej pracowni hemodynamiki jest bardzo duża, a od początku objawów upłynęło kilka godzin, oznaczenie troponiny może stanowić cenną wskazówkę co do ewentualnego występowania ostrego zespołu wieńcowego.
- niższa
Algorytm „rule in/rule out”
- Zastosowanie testów o wysokiej czułości do oznaczeń troponiny skróciło czas do wykrycia/wykluczenia NSTEMI („rule in/rule out”) w warunkach klinicznych.
- Dotychczas zalecano algorytm 0/3 godziny (czyli oznaczenie troponiny przy przyjęciu i 3 godziny później).
2425. - W nowych wytycznych ESC zaleca się stosowanie algorytmu 0/1 godziny (alternatywnie 0/2 godziny).
2527.- skrócony czas do rozpoznania, krótszy pobyt w Izbie Przyjęć/
- skrócony czas do rozpoznania, krótszy pobyt w Izbie Przyjęć/
- Lekarze powinni mieć świadomość, że oznaczenie troponiny nie zastępuje badania
przedmiotowegopodmiotowego ani EKG.2628.
Rozpoznanie na podstawie obrazu klinicznego, EKG i oznaczenia troponiny
- Przed rozpoczęciem dalszej diagnostyki wstępna ocena powinna być oparta na obrazie klinicznym, zmianach w EKG oraz wartościach troponiny.
- Troponinę należy interpretować jako marker ilościowy: im wyższy poziom troponiny, tym większe prawdopodobieństwo ostrego zawału mięśnia sercowego jako przyczyny.
2527. - Typowy obraz kliniczny i badania dodatkowe
2425- STEMI: silny, często typowy "stenokardialny" ból w klatce piersiowej (ewentualnie wstrząs kardiogenny, stan po resuscytacji), uniesienia odcinka ST, troponina wyraźnie podwyższona
- NSTEMI: typowe lub atypowe dolegliwości o różnym nasileniu, zmiany w odcinku ST-T (jednak prawidłowe EKG u ponad 1/3 pacjentów z NSTEMI!), podwyższenie troponiny od nieznacznego po istotne
- inne przyczyny sercowe (np. kardiomiopatia takotsubo, tachyarytmia): łagodne, nietypowe lub „typowe” dolegliwości, zmiany w odcinku ST-T, troponina nieznacznie podwyższona
- niestabilna dławica piersiowa: typowe lub nietypowe dolegliwości, ze zmianami w odcinku ST-T lub bez, troponina w normie
- przyczyna
niesercowapozasercowa (np. zespół ściany klatki piersiowej, zapalenie płuc): dolegliwości raczej nietypowe, brak zmian w EKG, troponina w normie
Alternatywne przyczyny podwyższenia poziomu troponiny2527
- Tachyarytmia
- Niewydolność serca
- Przełom nadciśnieniowy
- Poważne choroby (sepsa, wstrząs)
- Zapalenie mięśnia sercowego (myocarditis)
- Kardiomiopatia takotsubo
- Zdekompensowane wady zastawek (np. zwężenie zastawki aortalnej)
- Rozwarstwienie aorty
- Zatorowość płucna
- Niewydolność nerek
NiedokrwiennyudarUdar niedokrwienny mózgu/udar krwotoczny mózgu- Choroby naciekowe (np. amyloidoza, sarkoidoza)
nadczynnoNadczynność/niedoczynność tarczycy- Ekstremalny sport wytrzymałościowy
Diagnostyka specjalistyczna
Echokardiografia
- Badanie echokardiograficzne powinno być rutynowo dostępne na oddziałach ratunkowych/oddziałach „szybkiej diagnostyki bólu w klatce piersiowej”.
2527. - Echokardiografię należy wykonać u pacjentów z NSTEMI.
2527.- ocena globalnej i regionalnej kurczliwości lewej komory
wykluczenie/wykrycie w diagnostycediagnostyka różnicowejnicowa
- Po wykluczeniu ostrego zawału w razie potrzeby echokardiografia wysiłkowa w dalszym przebiegu w celu potwierdzenia/wykluczenia choroby wieńcowej
RM
- Przydatny w indywidualnych przypadkach w celu potwierdzenia diagnostyki różnicowej (np. zapalenie mięśnia sercowego, kardiomiopatia takotsubo)
TK
- Służy głównie do potwierdzenia
diagnostykichorób w diagnostyce różnicowej (zatorowość płucna, rozwarstwienie aorty). - TK należy rozważyć jako alternatywę dla badań inwazyjnych w przypadkach niskiego lub umiarkowanego prawdopodobieństwa choroby wieńcowej i niejednoznacznego wyniku EKG i/lub testu troponinowego.
- Opcja nieinwazyjnego wykluczenia lub wykrycia choroby wieńcowej po wykluczeniu ostrego zawału u pacjentów z niskim ryzykiem
2527,2927
Koronarografia
- W ostrym zespole wieńcowym koronarografia z ewentualną przezskórną interwencją wieńcową (PCI), czas wykonania zależny od stratyfikacji ryzyka
- Do zmiennych uwzględnionych w stratyfikacji ryzyka według skali GRACE należą: wiek, skurczowe ciśnienie tętnicze, tętno, kreatynina w surowicy, klasa niewydolności serca wg Killipa, troponina oraz zmiany odcinka ST.
- Cele koronarografii
2425- ostateczne potwierdzenie/wykluczenie całkowitej lub częściowej niedrożności naczyń wieńcowych
- rozpoznanie zmiany powodującej zawał
- kwalifikacja układu wieńcowego do PCI lub pomostowania aortalno-wieńcowego (coronary artery bypass grafting — CABG)
- stratyfikacja ryzyka
- po wykonaniu koronarografii, ewentualnie PCI (przezskórnej interwencji wieńcowej) z implantacją stentu
Wskazania do hospitalizacji
- Natychmiastowe przyjęcie pacjentów z podejrzeniem OZW (ostrego zespołu wieńcowego)
- Celem jest zminimalizowanie opóźnień w łańcuchu ratunkowym.
- wezwanie pomocy przez pacjenta lub bliskich (zwiększenie świadomości poprzez kampanie informacyjne)
- pierwszy kontakt z personelem medycznym (lekarz pogotowia, lekarz rodzinny)
celCel: jak najkrótszy czas do momentu przybycia pacjenta do pracowni hemodynamiki, jeśli istnieje wysokie prawdopodobieństwo ostrego zespołu wieńcowego.
- placówka medyczna, np. oddział „szybkiej diagnostyki bólu w klatce piersiowej”
- w przypadku przedszpitalnego rozpoznania STEMI — bezpośredni transport do pracowni hemodynamiki (oszczędność czasu ok. 20 minut)
- w przypadku pierwszego przyjęcia do szpitala bez pracowni hemodynamiki, docelowy czas do dalszego przeniesienia ≤30 minut („door-in/door-out”)
Leczenie
Cele terapiileczenia
- Złagodzenie ostrych objawów
- Ograniczenie do minimum uszkodzenia mięśnia sercowego
- Ponowne udrożnienie naczynia w ostrej niedrożności tętnic wieńcowych
- Zapobieganie ostrej niewydolności serca
- Zapobieganie powikł
ańaniom zawału - Zapobieganie
nawrotunawrotowi zawału - Zapobieganie przewlekłej niewydolności serca
ObniżenieZmniejszenie śmiertelności
Pierwsza pomoc w ostrym zespole wieńcowym (OZW) w praktyce lekarza rodzinnego
- W ramach pierwszej pomocy zalecane jest następujące postępowanie:
- ułożenie pacjenta w pozycji półwysokiej z uniesieniem górnej części tułowia pod kątem 30
°stopni - założenie dostępu dożylnego
- ASA
500150-300 mg doustnie lub 75-250 mg dożylnielub doustnie, jeśli pacjentjużnie przyjmuje tego leku na stałe. - nitrogliceryna (
psiknięciedawka aerozolu lubkapsułkitabletka pod język), jeśli BP skurczowe >100 mmHg- Nie należy podawać azotanów pacjentom z niedociśnieniem, znaczną bradykardią lub tachykardią, zawałem prawej komory, znanym ciężkim zwężeniem aorty lub stosującym inhibitor fosfodiesterazy 5 w ciągu ostatnich 24–48 godzin.
- w przypadku silnego bólu morfina 5 mg dożylnie; w razie potrzeby powtarzać aż do ustąpienia bólu (w Polsce rzadko dostępna w POZ)
- w przypadku nudności (wywołanych opiatami) 10 mg metoklopramidu dożylnie lub 62 mg dimenhydrynatu dożylnie (aktualnie niedostępny w Polsce)
- heparyna 5000 j.m. dożylnie lub enoksaparyna
-Na1 mg/kgmcm.c. podskórnie przy występowaniu zmian w EKG związanych z niedokrwieniem lub podwyższonych enzymów sercowych ( w Polsce rzadko dostępna w POZ) - w przypadku bradykardii atropina 1 mg dożylnie, w razie potrzeby można powtarzać do 3 mg
- po przyjeździe karetki pogotowia: monitorowanie rytmu serca i podawanie tlenu (2–4 l/minutę), w przypadku duszności lub innych objawów niewydolności serca, jeśli wysycenie tlenem
><90%, bez rutynowego podawania O2 - Należy rozważyć miareczkowane podawanie opioidów dożylne
dow celu analgezji. - U
bardzo lękowychpacjentów z dużym naisileniem lęku należy rozważyć podanie łagodnego leku uspokajającego (benzodiazepiny). - Skierowanie do oddziału kardiologii z założ
onymonącewnikiemkaniulą dożylnymylną (wenflonem)
- ułożenie pacjenta w pozycji półwysokiej z uniesieniem górnej części tułowia pod kątem 30
- W
omówiskonsultować zpracowniąhemodynamiki,kardiologiemczyinterwencyjnympożądanekoniecznośćjest przedkliniczne podaniepodania drugiego leku przeciwpłytkowego przed zabiegiem,alepomimo, że takie postępowanie nie jesttorutynowokonieczne rutynowostosowane. - Preferowaną substancją
możejestbyćtikagrelor w dawce nasycającej 180 mg doustnie.
Wytyczne dotyczące terapii w ostrym zespole wieńcowym2527,2830-2931
Terapia reperfuzyjna
- STEMI
- Terapia reperfuzyjna jest wskazana u wszystkich pacjentów z początkiem objawów w okresie 12 godzin.
- zalecenie pierwotnej PCI zamiast trombolizy
- Jeśli szybka PCI nie jest możliwa, zaleca się wykonanie trombolizy w ciągu 12 godzin od wystąpienia objawów.
- Terapia reperfuzyjna jest wskazana u wszystkich pacjentów z początkiem objawów w okresie 12 godzin.
- NSTEMI
- natychmiastowa koronarografia/PCI przy bardzo wysokim ryzyku (w ciągu 2 godzin)
- wczesna koronarografia/PCI przy wysokim ryzyku (w ciągu 24 godzin)
- elektywna koronarografia/PCI przy niskim ryzyku po nieinwazyjnym wykryciu niedokrwienia lub wykryciu niedrożnej choroby wieńcowej w TK naczyń wieńcowych
- Wybór stentu
- Zastosowanie DES (
Drugdrug-elutingStentsstents,stentówstenty uwalniającychce lek) nie wykazuje przewagi pod względem rokowania (zgon, zawał serca) w porównaniu z BMS (bare metal stents,stentamistentyniepowlekanyminiepowlekane), ale wiąże się z niższym odsetkiem restenozy/rewaskularyzacji.3032.
- Zastosowanie DES (
Profilaktyka wtórna — terapialeczenie przeciwzakrzepowaprzeciwzakrzepowe
- Po każdej postaci OZW (dławica piersiowa, NSTEMI lub STEMI) i niezależnie od początkowej terapii (zachowawcza, PCI lub CABG) należy
zaproponowastosować2 xtikagrelor 90 mgtikagreloru2 razy dziennie przez 1 rok w uzupełnieniu ASA, pod warunkiem dobrej tolerancji.- Jeśli tikagrelor nie jest tolerowany, należy
zaproponowastosować prasugrel w dawce 10 mgprasugreluprzez 12 miesięcy, a u pacjentów w wieku powyżej 75 lat i/lub o masie ciała poniżej 60 kg — 5 mgprasugrelu. - W przypadku nietolerancji tikagreloru po operacji wszczepienia bypassów (CABG) należy stosować wyłącznie ASA.
- Jeśli tikagrelor nie jest tolerowany, należy
- U pacjentów z wysokim ryzykiem krwawienia można rozważyć odstawienie inhibitora P2Y12.
- po 6 miesiącach od implantacji stentu
- po 1 miesiącu przy leczeniu zachowawczym
- Potrójna terapia (DAPT + OAC) po wszczepieniu stentu
- ASA i klopidogrel jako leki przeciwpłytkowe
,bez(nietikagrelorutikagrelor iprasugreluprasugrel) - U pacjentów wymagających doustnego leczenia przeciwkrzepliwego, którzy są poddawani PCI z powodu ostrego zespołu wieńcowego dowolnego rodzaju, obowiązują następujące zalecenia dotyczące czasu trwania potrójnej terapii:
- przy DES dowolnego typu — 6 miesięcy potrójnej terapii; następnie
OACNOAC + klopidogrel do 12 miesiąca, potem wyłącznieOACNOACz acenokumarolemlub acenokumarol/warfarynąwarfaryna - przy BMS — 4 tygodnie potrójnej terapii, następnie terapia przeciwzakrzepowa wyłącznie acenokumarolem/
- W razie znacznie podwyższonego ryzyka krwawienia podawanie ASA można ograniczyć do 4 tygodni, a klopidogrelu — do 6 miesięcy.
- przy DES dowolnego typu — 6 miesięcy potrójnej terapii; następnie
- Na czas trwania potrójnej terapii
należy wybrać wartośćINRwdolnym zakresie celu terapeutycznegopodczas stosowania acenokumarolu/warfarynywarfarynynależy utrzymywać wartość INR w dolnym zakresie terapeutycznym (np. 2,0–-2,5).- klopidogrel +
OACNOAC jako alternatywa u pacjentów z wysokim ryzykiem krwawienia
- klopidogrel +
- odstawienie podwójnej terapii przeciwpłytkowej po 12 miesiącach (IIa/B), kontynuacja
OACNOACz acenokumarolemlub acenokumarol/warfarynąwarfaryna (INR 2–3) - Jeśli
pacjenciuprzyjmującypacjentówterapięnaprzeciwkrzepliwąleczeniumusząprzeciwkrzepliwymbyćkoniecznapoddanijestinterwencjiinterwencja wieńcowejcowa, zamiastnowych doustnych leków przeciwkrzepliwychNOAC należy zastosować potrójną terapię z acenokumarolem lub warfaryną.
Profilaktyka wtórna — inne leki i styl życia
- Terapia statynami na stałe
- Beta-bloker, jeśli LVEF ≤40%
- Inhibitory ACE przy LVEF ≤40% (lub objawach niewydolności serca), nadciśnieniu tętniczym
- Antagoniści aldosteronu przy LVEF ≤35% i niewydolności serca lub cukrzycy
- Wszystkim pacjentom należy
doradzizalecić zmianę stylu życia (w tymrzuceniezaprzestanie palenia, aktywność fizyczną, zdrowe odżywianie) (I/A).
Leczenie w szpitalu
LeczenieEtapyodbywa się w serii etapów terapeutycznychleczenia:- leczenie objawowe bólu, duszności i lęku
- farmakoterapia okołozabiegowa
- PCI (przezskórna interwencja wieńcowa)
- leczenie powikłań
- profilaktyka wtórna: zmiana stylu życia, farmakoterapia, terapia z użyciem urządzeń
Terapia objawowa
- Opioidy do uśmierzenia bólu
- Morfina prowadzi
jednakdo opóźnienia jelitowego wchłaniania doustnych leków przeciwpłytkowych.2425.
- Morfina prowadzi
- Pacjentom z dużym lę
kowymkiem można podać benzodiazepinę.2830. - Rutynowe podawanie azotanów nie jest już zalecane.
2830.Podaniepodanie w nawracającej dławicy piersiowej, nadciśnieniu tętniczym lub objawach niewydolności serca
- Rutynowe podawanie O2 nie jest już zalecane ze względu na możliwe działania niepożądane.
3133-3234.- podawanie O2 tylko przy saturacji <90%
>
- podawanie O2 tylko przy saturacji <90%
Terapia przeciwzakrzepowa
Leczenie przeciwkrzepliwe
Pozajelitową terapię przeciwkrzepliwąLeczenie należy rozpocząć w momencie rozpoznania.2527.- Często stosuje się heparynę niefrakcjonowaną (70–100 j.m./kg m.c. dożylnie) i enoksaparynę (1 mg/kg m.c. podskórnie 2 x dziennie)
3335
Hamowanie agregacji płytek krwi
- W ostrym zespole wieńcowym (OZW) należy podać
500150-300 mg ASA, jeśli nie wprowadzono tego leczenia już wcześniej. - Czas podawania drugiego leku przeciwpłytkowego (dual antiplatelet therapy - DAPT
=Dual Antiplatelet Therapy) jest przedmiotem dyskusji; decyzję zwykle podejmuje się po przyjęciu/rozpoznaniu w klinice lub w pracownicewnikowaniahemodynamiki.1.Drugim lekiem przeciwpłytkowym z wyboru jest tikagrelor2 x90 mg 2 razy dziennie (przez 1 rok) w skojarzeniu z ASA.- Można podawać prasugrel, szczególnie u pacjentów ze STEMI.
2425.- ze względu na niekorzystny stosunek korzyści do ryzyka pierwotne stosowanie prasugrelu tylko w przypadku nietolerancji tikagreloru
3436
- ze względu na niekorzystny stosunek korzyści do ryzyka pierwotne stosowanie prasugrelu tylko w przypadku nietolerancji tikagreloru
- Klopidogrel w OZW jest obecnie alternatywną opcją leczenia tylko u pacjentów z przeciwwskazaniami do stosowania tikagreloru i prasugrelu (stan po krwotoku mózgowym, wskazanie do OAC).
Dalsza farmakoterapia
- Beta-blokery
- Beta-blokery zmniejszają zużycie tlenu przez mięsień sercowy poprzez zmniejszenie tętna, obniżenie ciśnienia tętniczego i kurczliwości.
2830 - U pacjentów stabilnych hemodynamicznie wczesne wprowadzenie beta-blokerów jest przydatne, jeśli utrzymują się objawy niedokrwienia.
2830 - Pacjenci, u których występuje zwiększone ryzyko wstrząsu kardiogennego (osoby starsze, tachykardia, BP skurczowe <120 mmHg).
3537-3638
- Beta-blokery zmniejszają zużycie tlenu przez mięsień sercowy poprzez zmniejszenie tętna, obniżenie ciśnienia tętniczego i kurczliwości.
- Statyny
Rewaskularyzacja
PCI (przezskórna interwencja wieńcowa) oraz tromboliza
STEMI
- Pierwotna PCI (przezskórna interwencja wieńcowa) w STEMI jest lepsza niż leczenie trombolityczne, które często stosowano w przeszłości.
3941-4042.- Tromboliza, po której wykonuje się PCI, nie daje żadnych korzyści w porównaniu z pierwotną PCI.
4143.
- Tromboliza, po której wykonuje się PCI, nie daje żadnych korzyści w porównaniu z pierwotną PCI.
- Trombolizę należy
wykonywazastosować tylko wtedy, gdy wykonanie pierwotnej PCI nie jest możliwe w krótkim czasie (12 h).2830. Chorych ze STEMI z objawami od28.Czas do udanego udrożnienia naczynia wpływa naNa wyniki leczenia u pacjentów ze STEMI wpływa czas do udanego udrożnienia naczynia.4345-4446.
NSTEMI
- Wykazano korzyści z rutynowej strategii inwazyjnej z rewaskularyzacją
w NSTEMIpodwzględempostaciąwskaźników:zmniejszenia4547-4749:- śmiertelności
- zawału mięśnia sercowego
- ponownej hospitalizacji
- Czas wykonania koronarografii/PCI w NSTEMI/niestabilnej dławicy piersiowej zależy od stratyfikacji ryzyka.
2527- natychmiastowa strategia inwazyjna (w czasie 2h)
- niestabilność hemodynamiczna
- oporna na leczenie dławica piersiowa
- zagrażające życiu arytmie
- powikłania mechaniczne
- ostra niewydolność serca
- nawracające dynamiczne zmiany odcinka ST
- wczesna strategia inwazyjna (w czasie 24 h)
- elektywna strategia inwazyjna przy niskim ryzyku
Decyzjadecyzja o badaniu inwazyjnym po wykonaniu badania w kierunku niedokrwienia lub TK naczyń wieńcowych
- natychmiastowa strategia inwazyjna (w czasie 2h)
Wybór stentu
- Zastosowanie DES (
Drugdrug-elutingStentsstents, stentów uwalniających lek) nie wykazuje przewagi pod względem rokowania (zgon, zawał serca) w porównaniu z BMS (bare metal stents, stentami niepowlekanymi), ale wiąże się z niższym odsetkiem restenozy/rewaskularyzacji.3032.
Dostęp naczyniowy
- Jeśli jest to technicznie możliwe, należy preferować dostęp promieniowy.25,28
- Dostęp promieniowy jest związany z mniejszą liczbą powikłań krwotocznych u pacjentów z OZW w porównaniu z dostępem udowym.
4850. Jeśli jest to technicznie możliwe, należy preferować dostęp promieniowy25,28.
Operacja wszczepienia bypassów wieńcowych (CABG)
- Pomostowanie aortalno-wieńcowe (coronary artery bypass graft — CABG) ma obecnie drugorzędne znaczenie w
opiecepostępowaniupodstawowejwostrego zespołu wieńcowegoOZW. - Po zaopatrzeniu naczynia zawałowego lub w chorobie wielonaczyniowej, po stratyfikacja ryzyka,
idyskusja/decyzja o dalszym postępowaniu odbywa się w „zespole sercowym” (HeartheartTeamteam, kardiolodzy i kardiochirurdzy).
Profilaktyka wtórna
Podwójna terapia przeciwpłytkowa (DAPT, dual antiplatelet therapy - DAPT)
- Pacjenci po zawale serca otrzymują ciągłą terapię przeciwpłytkową ASA.
- Wyjątkiem są pacjenci przyjmujący na stałe doustne leczenie
przeciwkrzepliweprzeciwzakrzepowe (OAC), u których po faziepodwpotrójnej terapiiprzeciwpłytkowejmożna stosować przewlekle wyłącznie OAC (patrz poniżej, punkt Potrójna terapia).
- Wyjątkiem są pacjenci przyjmujący na stałe doustne leczenie
- Podwójna terapia przeciwpłytkowa (
DualdualAntiplateletantiplateletTherapytherapy — DAPT) z użyciem ASA i inhibitora P2Y12 jest wskazana zarówno po PCI, jak i u pacjentów leczonych zachowawczo po OZW.2931. - Substancją preferowaną jako
II.drugi lek przeciwpłytkowy w ostrym zespole wieńcowym jest obecnie tikagrelor (dawka podtrzymująca2 x90 mg/d2 razy na dobę).2931.- Dotyczy to również pacjentów wcześniej leczonych klopidogrelem.
2931.
- Dotyczy to również pacjentów wcześniej leczonych klopidogrelem.
- Po każdej postaci OZW (dł
awicyawica piersiowa, NSTEMI albo STEMI) i niezależnie od początkowej terapii (zachowawcza, PCI lub CABG) należy stosować2 xtikagrelor w dawce 90 mgtikagreloru2 razy na dobę przez 1 rok w uzupełnieniu ASA, pod warunkiem dobrej tolerancji.- prasugrel jako alternatywa w przypadku nietolerancji tikagreloru
3436- Jeśli tikagrelor nie jest tolerowany, należy
zaproponowazastosować prasugrel w dawce 10 mgprasugreluprzez 12 miesięcy, a u pacjentów w wieku powyżej 75 lat i/lub o masie ciała poniżej 60 kg—w dawce 5 mgprasugrelu.
- Jeśli tikagrelor nie jest tolerowany, należy
- W przypadku nietolerancji tikagreloru po operacji wszczepienia bypassów (CABG) należy stosować wyłącznie ASA.
- prasugrel jako alternatywa w przypadku nietolerancji tikagreloru
- Czas trwania podwójnej terapii przeciwpłytkowej (DAPT) wynosi zazwyczaj 12 miesięcy, następnie stosuje się na stałe ASA.
- Jeśli ryzyko krwawienia jest wysokie, podwójną terapię przeciwpłytkową można skrócić do
2931:- 6 miesięcy po wszczepieniu stentu
- 1 miesiąca przy leczeniu zachowawczym
Potrójna terapia
- U pacjentów ze wskazaniem do doustnego leczenia przeciwkrzepliwego (najczęściej migotanie przedsionków lub zakrzepica), u których wykonuje się zabieg implantacji stentu, stosuje się potrójną terapię przez ograniczony czas.
- Ryzyko powikłań krwotocznych wzrasta wraz z liczbą stosowanych leków przeciwkrzepliwych.
- NNH (
NumbernumberNeededneeded toHarmharm — liczba osób, które trzeba leczyć przez określony czas, aby wystąpił niekorzystny punkt końcowy leczenia) wynosi 81 dla ASA +klopidogreluklopidogrel, 45 dla ASA +warfarynywarfaryna, 15 dlaklopidogreluklopidogrel +warfarynywarfaryna i 12 dla terapii potrójnej.4951. - W
nowychwytycznych ESC zaleca się dalsze skrócenie fazy potrójnej terapii po PCI, zarówno u pacjentów z OZW, jak i z przewlekłym zespołem wieńcowym.2527,5052.- przewlekły zespół wieńcowy (niezależnie od wybranego stentu):
- 1 tydzień terapii potrójnej, następnie odstawienie ASA
- OAC + klopidogrel przez 6 miesięcy
- następnie wyłącznie OAC
- OZW (niezależnie od wybranego stentu)
- 1 tydzień terapii potrójnej, następnie odstawienie ASA
- OAC + klopidogrel przez 12 miesięcy
- następnie wyłącznie OAC
- przewlekły zespół wieńcowy (niezależnie od wybranego stentu):
- Potrójna terapia z antagonistą witaminy K lub NOAC (doustne leki przeciwzakrzepowe nowej generacji)
- W terapii potrójnej
INR, przy doustnym leczeniu przeciwkrzepliwym acenokumarolem/ warfaryną - Potrójna terapia z NOAC budzi kontrowersje.
- W wytycznych ESC preferuje się łączenie NOAC z lekami przeciwpłytkowymi w miejsce skojarzenia z antagonistami witaminy K.
5052.
- W wytycznych ESC preferuje się łączenie NOAC z lekami przeciwpłytkowymi w miejsce skojarzenia z antagonistami witaminy K.
- W terapii potrójnej
Zmiana leków przeciwpłytkowych
- W razie zastąpienia jednego leku przeciwpłytkowego innym, w wytycznych DEGAM zaleca się następujące postępowanie:
Zmiana z klopidogrelu na tikagrelor
- Odstawienie klopidogrelu na 1–3 dni, następnie zmiana na tikagrelor
Zmiana z prasugrelu na klopidogrel
- Można przejść na zwykłą dawkę podtrzymującą klopidogrelu bez przerwy w terapii.
Zmiana z prasugrelu na tikagrelor
- Można przejść na zwykłą dawkę podtrzymującą tikagreloru bez przerwy w terapii.
Zmiana z tikagreloru na klopidogrel
- Dawka nasycająca 300 mg klopidogrelu, następnie zwykła dawka podtrzymująca 75 mg klopidogrelu dziennie.
Inna farmakologiczna profilaktyka wtórna oparta na lekach/zmiana stylu życia
Zob.Zobacz również artykuł Wtórna profilaktyka chorób wieńcowych.- Terapia statynami
- Terapię statynami należy rozpocząć jak najwcześniej po OZW i stosować długotrwale.
2527,2830. ZalecaneIstnieją poglądy, że zalecane przez towarzystwa kardiologiczne wartości docelowe LDL nie są poparte wystarczającymi dowodami, stądstrategianiektórzy proponują strategię stałej dawki:- przepisanie statyny w wysokiej dawce bez dalszych
kontrolibadań kontrolnych - stosowanie innych substancji tylko w przypadku nietolerancji statyn
- Jeśli terapia statyną w wysokiej dawce nie jest tolerowana, można
przepisazastosować ezetymib, inhibitory PCSK9.
- Jeśli terapia statyną w wysokiej dawce nie jest tolerowana, można
- przepisanie statyny w wysokiej dawce bez dalszych
-
- Polskie wytyczne postępowania w dyslipidemii rekomendują53:
- w prewencji wtórnej u pacjentów z grupy bardzo dużego ryzyka sercowo‑naczyniowego zmniejszenie stężenia LDL-C do wartości <1,4 mmol/l (<55 mg/dl) i o ≥50% w stosunku do wartości wyjściowej.
- u pacjentów po OZW rozważenie jako wartość docelową stężenie LDL-C <1,0 mmol/l (<40 mg/dl)
- Jeśli cele nie zostaną osiągnięte przy maksymalnej tolerowanej dawce statyny, zaleca się skojarzenie z ezetymibem i dalej z inhibitorem PCSK9.
- Polskie wytyczne postępowania w dyslipidemii rekomendują53:
- Beta-blokery
- Przyjęto, że beta-blokery stosuje się rutynowo, zwłaszcza u pacjentów po STEMI.
2830. - Beta-blokery są zdecydowanie wskazane w przypadku LVEF ≤40% i/lub objawów niewydolności serca.
2527,2830.
- Przyjęto, że beta-blokery stosuje się rutynowo, zwłaszcza u pacjentów po STEMI.
- Inhibitory ACE
- Inhibitory ACE są wskazane przy dysfunkcji lewej komory i/lub objawach niewydolności serca lub w nadciśnieniu.
2527,2830. - Zawał mięśnia sercowego nie jest sam w sobie wskazaniem do stosowania inhibitorów ACE, jeśli ciśnienie tętnicze nie jest podwyższone, a w ECHO nie wykazano upośledzonej kurczliwości serca.
- Antagoniści aldosteronu
- Stosowanie antagonistów aldosteronu jest wskazane w przypadku LVEF ≤40% i/lub objawów niewydolności serca.
nadciNadciśnienianienie tętniczegotnicze- leczenie hipotensyjne z docelowym ciśnieniem tętniczym <140/90 mmHg
cukrzycyCukrzyca- Wszystkich pacjentów z OZW należy poddać badaniom przesiewowym w kierunku cukrzycy, chyba że już ją wykryto.
2527. - Zasadniczo
terapialeczeniezgodnazgodne z wytycznymi, w niektórych grupach pacjentów (osoby starsze, zaawansowana choroba wieńcowa, pacjenci z wieloma chorobami współwystępującymi) należy rozważyć nieco mniej rygorystyczne podejście w osiąganiu celów glikemii.
- Wszystkich pacjentów z OZW należy poddać badaniom przesiewowym w kierunku cukrzycy, chyba że już ją wykryto.
- Pacjentom należy doradzić zmianę stylu życia:
- Szczepionka przeciwko
5255.
Rehabilitacja kardiologiczna
- Szczegółowe informacje znajdują się również w artykule Rehabilitacja kardiologiczna.
- Rehabilitację kardiologiczną po OZW należy rozpocząć jak najwcześniej, ale nie później niż 3 miesiące po wypisie ze szpitala.
- Rehabilitacja kardiologiczna prowadzi do poprawy stanu pacjentów w różnych obszarach
5356:- niższa śmiertelność
- spadek liczby hospitalizacji
- wzrost odporności
- lepsza jakość życia
- poprawa samopoczucia psychicznego
- Ważnymi elementami programu rehabilitacji są:
- porady dotyczące aktywności fizycznej, regularny trening na ergometrze
5457 - doradztwo żywieniowe
- kontrola czynników ryzyka
- ogólne porady zdrowotne
- wpływ na czynniki psychospołeczne
- komponenty społeczno-medyczne
- porady dotyczące aktywności fizycznej, regularny trening na ergometrze
Przebieg, powikłania i rokowanie
Powikłania
- Duży spadek liczby powikłań dzięki wczesnej rewaskularyzacji, jednak przebyty zawał mięśnia sercowego nadal stanowi istotną przyczynę zachorowalności/śmiertelności.2
. - Główne powikłania to:
- wstrząs kardiogenny
Niewydolnoniewydolność serca- powstanie tętniaka
aneurysmektomiaAneurysmektomiabeznie przynosi korzyści.
- rozwój zaawansowanej niedomykalności zastawki mitralnej
- spowodowana przez zmienioną konfigurację aparatu zastawkowego/dysfunkcję mięśnia brodawkowatego
- tworzenie się skrzepów
z tworzeniemzakrzepicasięprzyściennatętniakówlubkomorzebezw okolicy zawału- inne powikłania zakrzepowo-zatorowe
- leczenie przeciwkrzepliwe do 6 miesięcy pod kontrolą echokardiograficzną
2830
Arytmiaarytmia (migotanie komór, częstoskurcz komorowy, blok AV, migotanie przedsionków), nagły zgon sercowy- powikłania mechaniczne
- pęknięcie mięśnia brodawkowatego z ciężką niedomykalnością zastawki mitralnej
- pęknięcie wolnej ściany komory
- pęknięcie przegrody
Zapaleniezapalenie osierdzia (pericarditis)- wczesne zapalenie osierdzia po zawale mięśnia sercowego (wczesny początek, przemijające)
2830 - późne zapalenie osierdzia po zawale mięśnia sercowego (zespół Dresslera) po 1–2 tygodniach
- wczesne zapalenie osierdzia po zawale mięśnia sercowego (wczesny początek, przemijające)
Przebieg i rokowanie
- Poprawa opieki przedszpitalnej i leczenia szpitalnego doprowadziła w ciągu ostatnich dziesięcioleci do spadku śmiertelności.
- W latach 1994–2006, zależny od wieku i płci spadek śmiertelności szpitalnej o 30–50%
5558 - Obecnie śmiertelność 30-dniowa po zawale mięśnia sercowego wynosi
ok.około 7–105659 - Ze względu na niższą śmiertelność z powodu wczesnych powikłań, o długoterminowym rokowaniu coraz częściej przesądza rozwój niewydolności serca
. - Wcześniejsze różnice we wskaźnikach śmiertelności wśród kobiet i mężczyzn (wyższe u mężczyzn) stopniowo się wyrównują.
5962. - Czynnikami ryzyka gorszego rokowania są: zaawansowany wiek, nadciśnienie tętnicze, cukrzyca, choroba tętnic obwodowych (peripheral arterial disease - PAD) i stan po udarze.
5962.
Dalsze postępowanie
- Pierwsze badania kontrolne
ok.około 2–4 tygodnie pozawalehospitalizacji z powodu zawału mięśnia sercowego - Regularne badanie przez lekarza rodzinnego (co
1/43 do1/26rokumiesięcy) u pacjentów z chorobą wieńcową, niezależne od innych koniecznych konsultacji (pogorszenie stanu zdrowia, choroby współwystępujące). - Opieka realizowana wspólnie przez lekarza rodzinnego i kardiologa u pacjentów z:
- OZW w ciągu ostatniego roku
- niewydolnością serca klasy III–IV wg NYHA
- komorowymi zaburzeniami rytmu serca, ICD
- Skierowanie od lekarza rodzinnego do kardiologa w następujących sytuacjach:
SatysfakcjonujNie jest możliwe satysfakcjonujące leczenie objawowe na poziomielekarzaopiekirodzinnegopodstawowejnie(zagrożony jestmożliwe (cel terapiiukierunkowanymający na celu poprawę jakości życiajest zagrożony).- Nie
majest możliwoliwe zastosowanie ści,rodkówbyterapeutycznych i innych środków w celu wystarczającoskutecznieskutecznejstosowaćpoprawyśrodki lecznicze i inne środki poprawiające rokowanierokowania (zagrożony jest cel terapiiukierunkowanymający na celu poprawę rokowaniajest zagrożony). znaczneznaczące pogorszenie rozpoznanej wcześniej niewydolności serca lub jej podejrzenie- nowe, klinicznie istotne arytmie serca
- U osób po OZW
zalecanyzaleca się jestudziałuczestnictwo w grupie wsparcia dla pacjentów kardiologicznych. - W Polsce dostępny jest program finansowany przez Narodowy Fundusz Zdrowia (KOS-zawał) - kompleksowa specjalistyczna opieka w zakresie leczenia szpitalnego, ambulatoryjnego i rehabilitacji kardiologicznej,
Informacje dla pacjentów
Informacje dla pacjentów w Deximed
Zawał mięśnia sercowego
- Zawał mięśnia sercowego
- Zawał mięśnia sercowego, rehabilitacja
- Zawał mięśnia sercowego, tromboliza
- Przezskórna interwencja wieńcowa (PCI)
- Operacja wszczepienia bypassów (CABG)
Porady zdrowotne
- Pełnowartościowa dieta
- Żywność niskotłuszczowa
- Dlaczego warto rzucić palenie papierosów i jak to zrobić?
- Trening siłowy — dobry dla serca
- Nadwaga i redukcja masy ciała — jak to zrobić?
Ilustracje
- Patrz EKG: ostry zawał serca ściany przedniej (STEMI)
- Patrz EKG: Ostry zawał serca ściany dolnej (STEMI)
- Patrz EKG: częstoskurcz komorowy przed kardiowersją i po kardiowersji (zawał ściany dolnej)

Zawał, zmiana EKG w czasie
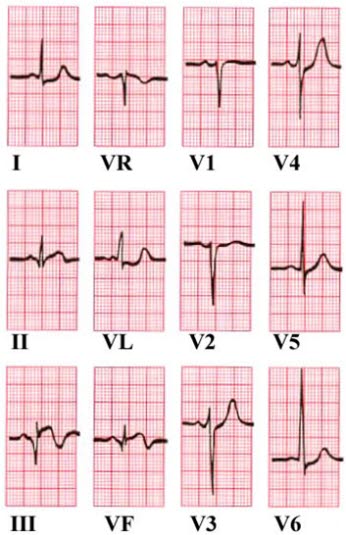
Załamki Q w odprowadzeniu III i aVF. Uniesienie odcinka ST w odprowadzeniu II i aVF. Obniżenie odcinka ST w aVL i V6.
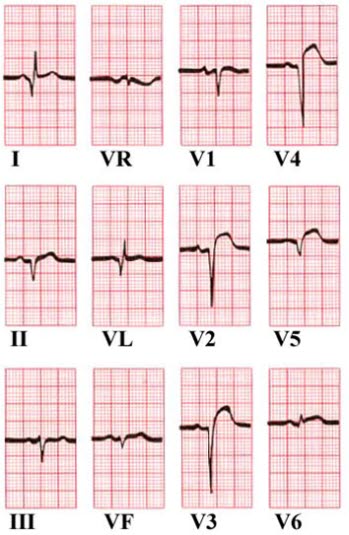
Uniesienie odcinka ST w odprowadzeniach V2–V5
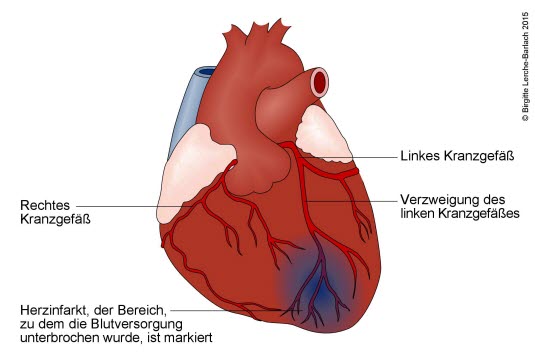
Serce w zawale
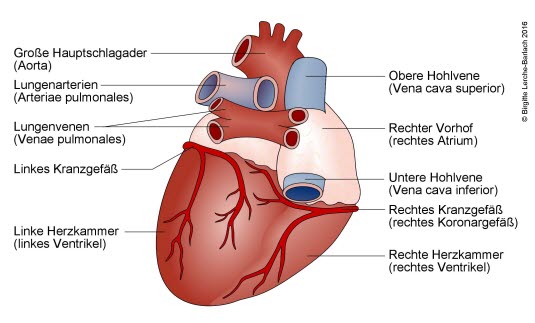
Serce prawidłowe, widok od tyłu
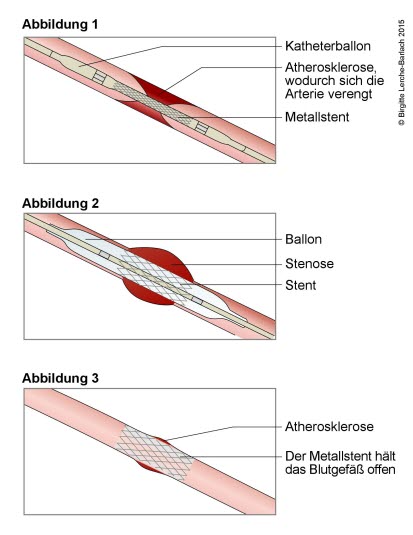
Stentowanie zwężenia naczynia krwionośnego
Źródła
Wytyczne
- European Society of Cardiology (Europejskie Towarzystwo Kardiologiczne, ESC). Fourth Universal Definition of Myocardial Infarction (Czwarta uniwersalna definicja zawału serca). Stan z 2018 roku. www.escardio.org.
- European Society of Cardiology (Europejskie Towarzystwo Kardiologiczne, ESC). Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation (Wytyczne postępowania w ostrym zawale mięśnia sercowego u pacjentów z uniesieniem odcinka ST). Stan z 2017 roku. www.escardio.org.
- European Society of Cardiology (Europejskie Towarzystwo Kardiologiczne, ESC). Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation (Wytyczne postępowania w ostrych zespołach wieńcowych u pacjentów bez przetrwałego uniesienia odcinka ST). Stan z 2020 roku. www.escardio.org
- European Society of Cardiology (Europejskie Towarzystwo Kardiologiczne, ESC). Focused update on dual antiplatelet therapy in coronary artery disease developed (Ukierunkowana aktualizacja wytycznych w zakresie podwójnej terapii przeciwpłytkowej w chorobie wieńcowej). Stan z 2017 roku. www.escardio.org.
- European Society of Cardiology (Europejskie Towarzystwo Kardiologiczne, ESC). Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death (Wytyczne dotyczące postępowania z pacjentami z komorowymi zaburzeniami rytmu i profilaktyki nagłego zgonu sercowego). Stan z 2015 roku. www.escardio.org
- European Society of Cardiology (Europejskie Towarzystwo Kardiologiczne, ESC). Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS) (Wytyczne dotyczące rozpoznawania i leczenia migotania przedsionków opracowane we współpracy z Europejskim Stowarzyszeniem Chirurgii Kardio-Torakochirurgicznej). Stan z 2020 roku. www.escardio.org
Piśmiennictwo
- Thygesen K, Alpert J, Jaffe A, et al. Fourth universal definition of myocardial infarction (2018). Eur Heart J 2019; 40: 237-269. doi:10.1093/eurheartj/ehy462 DOI
- Anderson L, Morrow D. Acute Myocardial Infarction. N Engl J Med 2017; 376: 2053-2064. doi:10.1056/NEJMra1606915 DOI
- Gąsior M, Poloński L. Zawał mięśnia sercowego w Polsce - gdzie byliśmy, gzie jesteśmy, dokąd zmierzamy. PAN. publikacje.pan.pl
- Bansilal S, Castellano J, Fuster V. Global burden of CVD: focus on secondary prevention of cardiovascular disease. Int J Cardiol 2015; 201: S1-S7. doi:10.1016/S0167-5273(15)31026-3 DOI
- Zafari A. Acute Myocardial Infarction. Medscape. Updated February 11, 2018. Zugriff 23.06.18 emedicine.medscape.com
- Falk E, Shah P, Fuster V. Coronary Plaque Disruption. Circulation 1995; 92: 657-671. doi:10.1161/01.CIR.92.3.657 DOI
- Shibata T, Kawakami S, Noguchi T, et al. Prevalence, Clinical Features, and Prognosis of Acute Myocardial Infarction Due to Coronary Artery Embolism. Circulation 2015; 132: 241-250. doi:10.1161/CIRCULATIONAHA.114.015134 DOI
- Ertan C, Özpelit M, limon Ö, et al. Vasospastic myocardial infarction: An even rarer occurrence of a rare entity. World J Emerg Med 2017; 8: 68-70. pubmed.ncbi.nlm.nih.gov
- Heusch G, Gersh B. The pathophysiology of acute myocardial infarction and strategies of protection beyond reperfusion: a continual challenge. Eur Heart J 2017; 38: 774–784. doi:10.1093/eurheartj/ehw224 DOI
- Yusuf S, Hawken S, Ôunpuu S, et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet 2004; 364: 937-52. doi:10.1016/S0140-6736(04)17018-9 DOI
- Dhingra R, Vasan R. Age as a Cardiovascular Risk Factor. Med Clin North Am 2012; 96: 87-91. www.ncbi.nlm.nih.gov
- Anand S, Islam S, Rosengren A, et al. Risk factors for myocardial infarction in women and men: insights from the INTERHEART study. Eur Heart J 2008; 29: 932–940. doi:10.1093/eurheartj/ehn074 DOI
- Roncaglioni M, Santoro L, D'Avanzo B, et al . Role of Family History in Patients With Myocardial Infarction. Circulation 1992; 85: 2065-2072. pmid:1591825 PubMed
- Culic W. Acute risk factors for myocardial infarction. Int J Cardiol 2007; 117: 260-269. doi:10.1016/j.ijcard.2006.05.011 DOI
- Lindhardsen J, Ahlehoff O, Gislason GH, et al. The risk of myocardial infarction in rheumatoid arthritis and diabetes mellitus: a Danish nationwide cohort study. Ann Rheum Dis 2011; 70: 929-934. PubMed
- Mehta NN, Yu Y, Pinnelas R, et al. Attributable risk estimate of severe psoriasis on major cardiovascular events. Am J Med 2011; 124: 775. www.ncbi.nlm.nih.gov
- Olsen AM, Fosbøl EL, Lindhardsen J, et al. Long-term cardiovascular risk of NSAID use according to time passed after first-time myocardial infarction. A nationwide cohort study. Circulation 2012. www.ncbi.nlm.nih.gov
- Trelle S, Reichenbach S, Wandel S et al. Cardiovascular safety of non-steroidal anti-inflammatory drugs: network meta-analysis. BMJ 2011:342:c7086. www.bmj.com
- Hsia J, Larson JC, Ockene JK, et al. Resting heart rate as a low tech predictor of coronary events in women: prospective cohort study. BMJ 2009; 338: b219. www.ncbi.nlm.nih.gov
- Kwong JC, Schwartz KL, Campitelli MA, et al. Acute myocardial infarction after laboratory-confirmed influenza infection. N Engl J Med 2018 Jan 25; 378(4): 345-353. pmid:29365305 PubMed
- McSweeney JC, Cody M, Sullivan P, et al. Women's early warning symptoms of acute myocardial infarction. Circulation 2003; 108: 2619-23. www.ncbi.nlm.nih.gov
- Khan N, Daskalopoulou S, Karp I, et al. Sex differences in prodromal symptoms in acute coronary syndrome in patients aged 55 years or younger. Heart 2017; 103: 863-869. doi:10.1136/heartjnl-2016-309945 DOI
- Milner KA, Vaccarino V, Arnold AL, et al. Gender and age differences in chief complaints of acute myocardial infarction.. Am J Cardiol 2004; 93: 606-8. www.sciencedirect.com
- Dezman Z, Mattu A, Body R, et al. Utility of the History and Physical Examination in the Detection of Acute Coronary Syndromes in Emergency Department Patients. West J Emerg Med 2017; 18: 752-760. www.ncbi.nlm.nih.gov
- Roffi M, Patrono C, Collet J, et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J 2016; 37: 267–315. doi:10.1093/eurheartj/ehv320 DOI
- Budaj A, Bednarz B, Leśniak W. Ostre zespoły wieńcowe. Interna- Mały Podręcznik. Medycyna Praktyczna. (dostęp 17.02.2024) www.mp.pl
- Collet J, Thiele H, Barbato E, et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presentingwithoutpersistentST-segment elevation. Eur Heart J 2020; 00: 1-79. doi:10.1093/eurheartj/ehaa575 DOI
- Ammann P, Pfisterer M, Fehr T, Rickli H. Raised cardiac troponins. BMJ 2004; 328: 1028-9. PubMed
- Maffei E, Seitun S, Martini C, et al. CT coronary angiography and exercise ECG in a population with chest pain and low-to-intermediate pre-test likelihood of coronary artery disease. Heart 2010; 96: 1973-9 PubMed
- Ibanez B, James S, Agewall S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2018; 39: 119-177. doi:10.1093/eurheartj/ehx393 DOI
- Valgimigli M, Bueno H, Byrne R, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS. Eur Heart J 2018; 39: 213–254. doi:10.1093/eurheartj/ehx419 DOI
- Bønaa et al. Drug-Eluting or Bare-Metal Stents for Coronary Artery Disease. N Engl J Med 2016;375:1242-52. www.ncbi.nlm.nih.gov
- Sepehrvand N, James SK, Stub D, et al. Effects of supplemental oxygen therapy in patients with suspected acute myocardial infarction: a meta-analysis of randomised clinical trials. Heart 2018 Mar 29. pmid:29599378 PubMed
- Cabello JB, Burls A, Emparanza JI, Bayliss SE, Quinn T. Oxygen therapy for acute myocardial infarction. Cochrane Database of Systematic Reviews Issue 12. pubmed.ncbi.nlm.nih.gov
- Eikelboom JW, Anand SS, Malmberg K, Weitz JI, Ginsberg JS, Yusuf S. Unfractioned heparin and low-molecular-weight heparin in acute coronary syndrome without ST elevation: a mata analysis. Lancet 2000; 355: 1936-42. PubMed
- Schüpke S, Neumann FJ, Menichelli M et al for the ISAR-REACT 5 trial investigators. Ticagrelor or Prasugrel in patients with acute coronary syndromes. N Engl J Med. 2019 Oct 17;381(16):1524-1534. www.ncbi.nlm.nih.gov
- Kontos M, Diercks D, Ho P, et al. Treatment and outcomes in patients with myocardial infarction treated with acute β-blocker therapy: results from the American College of Cardiology's NCDR(®). Am Heart J 2011; 161: 864-870. doi:10.1016/j.ahj.2011.01.006 DOI
- Bangalore S, Makani H, Radford M, et al. Clinical Outcomes with beta-Blockers for Myocardial Infarction: A Meta-analysis of Randomized Trials. Am J Med. 2014 Oct;127(10):939-53. PubMed
- Schwarzt G, Olsson A, Ezekowitz M, et al. Effects of Atorvastatin on early recurrent ischemic events in acute coronary syndromes: the MIACL study. JAMA 2001;285:1711-1718. www.ncbi.nlm.nih.gov
- Baigent C, Blackwell L, Emberson J, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170 000 participants in 26 randomised trials. Lancet 2010; 376: 1670-1681. www.ncbi.nlm.nih.gov
- Zijlstra F, Hoorntje J, de Boer M, et al. Long-Term Benefit of Primary Angioplasty as Compared with Thrombolytic Therapy for Acute Myocardial Infarction. New Engl J Med 1999; 341: 1413-1419. doi:10.1056/NEJM199911043411901 DOI
- Keeley E, Boura J, Grines C. Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction: a quantitative review of 23 randomised trials. Lancet 2003; 361: 13-20. doi:10.1016/S0140-6736(03)12113-7 DOI
- Armstrong PW, Gershlick AH, Goldstein P, et al. Fibrinolysis or primary PCI in ST-segment elevation myocardial infarction. N Engl J Med 2013. doi:10.1056/NEJMoa1301092 DOI
- Cantor WJ, Fitchett D, Borgundvaag B, et al, for the TRANSFER-AMI Trial Investigators. Routine early angioplasty after fibrinolysis for acute myocardial infarction. N Eng J Med 2009; 360: 2705-18. www.nejm.org
- McNamara RL, Wang Y, Herrin J, et al, for the NRMI Investigators. Effect of door-to-balloon time on mortality in patients with ST-segment elevation myocardial infarction. J Am Coll Cardiol 2006; 47: 2180-6. PubMed
- De Luca G, Biondi-Zoccai G, Marino P. Transferring patients with ST-segment elevation myocardial infarction for mechanical reperfusion: a meta-regression analysis of randomized trials. Ann Emerg Med 2008; 52: 665-76. PubMed
- Bavry A, Kumbhani D, Rassi A, et al. Benefit of early invasive therapy in acute coronary syndromes: a meta-analysis of contemporary randomized clinical trials. J Am Coll Cardiol 2006; 48: 1319-1325. doi:10.1016/j.jacc.2006.06.050 DOI
- O'Donoghue M, Boden W, Braunwald E, et al. Early invasive vs conservative treatment strategies in women and men with unstable angina and non-ST-segment elevation myocardial infarction: a meta-analysis. JAMA 2008; 300: 71-80. doi:10.1001/jama.300.1.71 DOI
- Fox K, Clayton T, damman P, et al. Long-term outcome of a routine versus selective invasive strategy in patients with non-ST-segment elevation acute coronary syndrome a meta-analysis of individual patient data. J Am Coll Cardiol 2010; 55: 2435-2445. doi:10.1016/j.jacc.2010.03.007 DOI
- Valgimigli M, Gagnor A, Calabro P, et al. Radial versus femoral access in patients with acute coronary syndromes undergoing invasive management: a randomised multicentre trial. Lancet ; 385: 2465-76. doi:10.1016/S0140-6736(15)60292-6 DOI
- Sørensen R, Hansen ML, Abildstrom SZ, et al. Risk of bleeding in patients with acute myocardial infarction treated with different combinations of aspirin, clopidogrel, and vitamin K antagonists in Denmark: a retrospective analysis of nationwide registry data. Lancet 2009; 374: 1967-74. PubMed
- Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2020; 00: 1-126. doi:10.1093/eurheartj/ehaa612 www.escardio.org
- Banach M, Burchardt P, Chlebus K. et al. Wytyczne PTL/KLRwP/PTK/PTDL/PTD/PTNT diagnostyki i leczenia zaburzeń lipidowych w Polsce 2021. Lekarz Rodzinny 4/2021 (Suppl). www.termedia.pl
- Choo EH, Chang K, Ahn Y, et al. Benefit of β-blocker treatment for patients with acute myocardial infarction and preserved systolic function after percutaneous coronary intervention. Heart 2013. doi:10.1136/heartjnl-2013-305137 DOI
- Udell JA, Zawi R, Bhatt DL, et al. Association between influenza vaccination and cardiovascular outcomes in high-risk patients: a meta-analysis. JAMA 2013 Oct 23;310(16):1711-20. PubMed
- Bäck M, Hansen T, Frederix I. European Society of Cardiology. Rehabilitation and exercise training recommendations. Stand 30.06.17. Zugriff 08.06.18 www.escardio.org
- Heran BS, Chen JMH, Ebrahim S, Moxham T, Oldridge N, Rees K, Thompson DR, Taylor RS. Exercise-based cardiac rehabilitation for coronary heart disease. Cochrane Database of Systematic Reviews 2011, Issue 7. Art. No.: CD001800. DOI: 10.1002/14651858.CD001800.pub2. pubmed.ncbi.nlm.nih.gov
- Vaccarino V, Parsons L, Peterson ED, et al. Sex differences in mortality after acute myocardial infarction. Arch Intern Med 2009; 169: 1767-74. PubMed
- Chung S, Gedeborg R, Nicholas O, et al. Acute myocardial infarction: a comparison of short-term survival in national outcome registries in Sweden and the UK. Lancet 2014; 383: 1305–12. www.ncbi.nlm.nih.gov
- Schmidt M, Szepligeti S, Horváth-Puhó E, et al. Long-Term Survival Among Patients With Myocardial Infarction Before Age 50 Compared With the General Population. Circ Cardiovasc Qual Outcomes 2016; 9: 523-531. doi:10.1161/CIRCOUTCOMES.115.002661 DOI
- Chapman et al. Association of High-Sensitivity Cardiac Troponin I Concentration With Cardiac Outcomes in Patients With Suspected Acute Coronary Syndrome. JAMA 2017 Nov 21;318(19):1913-1924. www.ncbi.nlm.nih.gov
- Johansson S, Annika Rosengren A, Young K, et al. Mortality and morbidity trends after the first year in survivors of acute myocardial infarction: a systematic review. BMC Cardiovasc Disord 2017; 17: 53. doi:10.1186/s12872-017-0482-9 DOI
Autorzy
- Michael Handke, prof. dr hab. med., specjalista chorób wewnętrznych, kardiologii i intensywnej terapii, Fryburg Bryzgowijski
- Günther Egidi, dr med., lekarz rodzinny, Brema (recenzja)