Informacje ogólne
Definicja
- Nowotwór płuc jest zdecydowanie najczęstszym guzem złośliwym wywodzącym się z tkanki płucnej.
- Pod wpływem nazewnictwa międzynarodowego coraz bardziej upowszechnia się termin „rak płuc” (ang. lung cancer).
- Rozróżnia się cztery główne grupy histologiczne:
- rak płaskonabłonkowy (30–40%)
- gruczolakorak (25–30%)
- rak wielkokomórkowy (<10%)>
- rak drobnokomórkowy (15–20%)
- Drobnokomórkowy nowotwór płuca jest szczególnie agresywnym typem nowotworu płuc z tendencją do wczesnego rozsiewania się.
Klasyfikacja TNM1
- T (guz)
- CIS: carcinoma in situ
- T1: guz o największym wymiarze <3 cm, otoczony miąższem płucnym lub opłucną trzewną, nie nacieka oskrzela głównego>
- T1a(mi): gruczolakorak minimalnie inwazyjny (gruczolakorak ze wzrostem lepidowym <3 cm w największym wymiarze z litą częścią wielkości><5 mm)>
- T1a: guz o największym wymiarze <1 cm>
- T1b: guz o największym wymiarze >1 cm, ale <2 cm>
- T1c: guz o największym wymiarze >2 cm, ale <3 cm>
- T2: guz o największym wymiarze >3 cm, ale <5 cm lub>
- naciekający oskrzele główne, ale niedochodzący do ostrogi tchawicy, niezależnie od odległości od ostrogi, lub
- naciekający opłucną trzewną, lub
- guz powodujący częściową niedodmę lub obturacyjne zapalenie płuc sięgające okolicy wnęki, obejmujące część płuca lub całe płuco
- T2a: guz o największym wymiarze >3 cm, ale <4 cm>
- T2b: guz o największym wymiarze >4 cm, ale <5 cm>
- T3: guz o największym wymiarze >5 cm, ale <7 cm lub>
- naciekający ścianę klatki piersiowej (w tym opłucną ścienną i bruzdę górną), nerw przeponowy lub osierdzie ścienne, lub
- guz z odrębnymi ogniskami raka w obrębie tego samego płata płuca co guz pierwotny
- T4: guz o największym wymiarze >7 cm lub
- bezpośrednio naciekający przeponę, śródpiersie, serce, duże naczynia, tchawicę, nerw krtaniowy wsteczny, przełyk, trzony kręgowe lub ostrogę tchawicy, lub
- guz z odrębnymi ogniskami raka w obrębie innego płata płuca po tej samej stronie
- N (węzły chłonne)
- N0: bez przerzutów do węzłów chłonnych
- N1: przerzuty do węzłów chłonnych okołooskrzelowych i/lub wnękowych po stronie guza i/lub wewnątrzpłucnych węzłów chłonnych lub ich bezpośrednie naciekanie
- N2: przerzuty do węzłów chłonnych śródpiersiowych i/lub podostrogowych po stronie guza
- N3: przerzuty do węzłów chłonnych śródpiersia, węzłów chłonnych wnękowych po przeciwległej stronie, głębokich węzłów chłonnych szyjnych po stronie guza lub po przeciwległej stronie, nadobojczykowych węzłów chłonnych
- M (przerzuty)
- M0: bez przerzutów odległych
- M1: przerzuty odległe
- M1a:
- odrębne ognisko(-a) raka w płacie płuca po przeciwległej stronie, lub
- ogniska raka w opłucnej lub
- nowotworowy wysięk opłucnowy, lub
- nowotworowy wysięk osierdziowy
- M1b: pojedyncze przerzuty odległe w pojedynczym narządzie poza klatką piersiową
- M1c: mnogie przerzuty odległe w jednym narządzie lub wielu narządach
Podział na stadia
- Stadium 0: CIS N0 M0
- Stadium IA1:
- T1a (mi) N0 M0 lub
- T1a N0 M0
- Stadium IA2: T1b N0 M0
- Stadium IA3: T1c N0 M0
- Stadium IB: T2a N0 M0
- Stadium IIA: T2b N0 M0
- Stadium IIB:
-
- T1a-c N1 M0 lub
- T2a,b N1 M0 lub
- T3 N0 M0
- Stadium IIIA:
- T1a-c N2 M0 lub
- T2a,b N2 M0 lub
- T3 N1 M0 lub
- T4 N0 M0 lub
- T4 N1 M0
- Stadium IIIB:
- T1a-c N3 M0 lub
- T2a,b N3 M0 lub
- T3 N2 M0 lub
- T4 N2 M0
- Stadium IIIC:
- T3 N3 M0
- T4 N3 M0
- Stadium IVA: każde T, każde N, M1a lub M1b
- Stadium IVB: każde T, każde N, M1c
Częstość występowania
- Rak płuc jest najczęstszą przyczyną zgonów spowodowanych nowotworami u mężczyzn i trzecią najczęstszą przyczyną u kobiet.
- Zapadalność u mężczyzn wynosi ok. 65, a u kobiet ok. 20 na 100 tys. rocznie.
- Najwyższa zapadalność dotyczy przedziału wiekowego 75–80 lat.
- Wraz ze wzrostem konsumpcji papierosów od kilku dekad rośnie zapadalność wśród kobiet. W przypadku mężczyzn zapadalność jest niezmienna lub nieznacznie spada.
Etiologia i patogeneza
- Palenie papierosów
- Jest najważniejszym znanym czynnikiem ryzyka rozwoju nowotworu płuc u mężczyzn i kobiet.
- U 80–90% chorych występuje palenie w wywiadzie.
- Papierosy o niższej zawartości substancji smolistych nie zmniejszają ryzyka zachorowania na nowotwór płuc.
- Inne postaci palenia
- Również wiążą się ze zwiększonym ryzykiem nowotworu płuc i innych nowotworów (np. palenie fajki i cygar); jednak największe ryzyko stwarza palenie papierosów.
- Wpływ środowiska i związana z pracą ekspozycja na czynniki, które mogą zwiększać ryzyko:
- drobny pył, na przykład w spalinach silników wysokoprężnych
- Zwiększona ekspozycja na radon w budynkach może prowadzić do lokalnego zwiększenia przypadków nowotworów płuc. Według badań przeprowadzonych w Wielkiej Brytanii 3,3% zgonów z powodu raka płuc było poprzedzonych zwiększoną ekspozycją na radon.
- promieniowanie jonizujące
- azbest
- metale ciężkie, takie jak chromiany, arsen i nikiel
- węglowodory wielopierścieniowe, takie jak sadza i smoła
Podział histologiczny
- Typ histologiczny jest ważny z punktu widzenia leczenia i rokowania. Rozróżnia się raka drobnokomórkowego i niedrobnokomórkowego:
- rak drobnokomórkowy
- rak niedrobnokomórkowy
- gruczolakorak
- rak płaskonabłonkowy
- rak wielkokomórkowy
- Drobnokomórkowy rak płuca
- 15–20 % wszystkich nowotworów płuc
- Z reguły szybko rośnie.
- rzadki u osób niepalących
- umiejscowiony przeważnie w głównych drogach oddechowych (oskrzele główne i tchawica) z wczesnym rozsiewem lokoregionalnym do śródpiersia
- często wczesne przerzuty zewnątrzpiersiowe
- często zespół paraneoplastyczny
- Choć guz dobrze reaguje na chemoterapię, drobnokomórkowy rak płuca często jest już w zaawansowanym stadium w momencie rozpoznania, a rokowanie jest niekorzystne.
- gruczolakorak
- 25–30% wszystkich nowotworów płuc
- histologicznie niejednorodny
- najczęściej w obwodowych obszarach płuca
- wczesne przerzuty
- często poprzedzony chorobą płuc
- Rak płaskonabłonkowy
- 30–40% wszystkich nowotworów płuc
- umiejscowiony zwykle wewnątrzoskrzelowo w ośrodkowych drogach oddechowych
- często z krwiopluciem, poobturacyjnym zapaleniem płuc lub odmą opłucnową
- przerzuty w przebiegu choroby pojawiają się zazwyczaj późno
- Rak wielkokomórkowy
- mniej niż 10% wszystkich nowotworów płuc
- słabo zróżnicowany
- duże guzy obwodowe
- wczesne przerzuty
Czynniki predysponujące
- Palenie papierosów
- U 9 na 10 kobiet i 8 na 10 mężczyzn z nowotworem płuc występuje palenie papierosów w wywiadzie.
- Około 10% wszystkich przypadków raka płuc dotyczy osób niepalących.
- Według badań epidemiologicznych bierne palenie również wiąże się ze zwiększonym ryzykiem zachorowania na raka płuc.
- Narażenie w związku z wykonywaną pracą
- Azbest jest najczęstszym czynnikiem ryzyka związanym z pracą zawodową. U osoby narażonej na działanie azbestu ryzyko zachorowania na raka płuc jest 6 razy wyższe niż u osoby, która nie miała kontaktu z azbestem. U palaczy narażonych na działanie azbestu ryzyko jest nawet 60-krotnie wyższe.
- narażenie na pył, gazy, chemikalia itp. (np. arsen, chrom, nikiel, chlorek winylu i promieniowanie jonizujące)
- Narażenie na kontakt z radonem w budynkach
- Spośród wszystkich zanieczyszczeń powietrza najwyższe ryzyko zachorowania na raka płuc powoduje drobny pył zawarty w spalinach silników wysokoprężnych.
- Przewlekła obturacyjna choroba płuc, idiopatyczne zwłóknienie płuc, gruźlica
- Ze zwiększonym ryzykiem zachorowania na raka płuc wiążą się zakażenia niektórymi wirusami.
- W przypadku wirusa brodawczaka ludzkiego (HPV) związek ten jest szczególnie widoczny w Azji i Afryce, ale prawdopodobnie odgrywa pewną rolę także w Europie.
- Zakażenia wywołane przez wirusa Epsteina-Barr (EBV) wiążą się ze zwiększonym ryzykiem wystąpienia wielkokomórkowego raka limfoepitelialnego.
- U osób zakażonych HIV zwiększone ryzyko raka płuc jest prawdopodobnie związane ze szczególnie wysokim odsetkiem osób palących.
- Czynniki genetyczne zdają się odgrywać pewną rolę, ale nie zostały jeszcze wystarczająco zbadane. U palaczy dominują inne podtypy genetyczne raka płuc niż u osób niepalących.
ICD-10
- C34 Nowotwór złośliwy oskrzela i płuca
- C34.0 Oskrzele główne
- C34.1 Płat górny płuca lub oskrzele płatowe górne
- C34.2 Płat środkowy płuca lub oskrzele płatowe środkowe
- C34.3 Płat dolny płuca lub oskrzele płatowe dolne
- C34.8 Zmiana przekraczająca granice jednego umiejscowienia w obrębie oskrzela i płuca
- C34.9 Oskrzele lub płuco, umiejscowienie nieokreślone
Diagnostyka
Wczesne wykrywanie
TK co roku w przypadku podwyższonego ryzyka
- Definicja osoby z grupy ryzyka
- Wiek 50–75 lat oraz
- ≥15 papierosów dziennie przez co najmniej 30 lat, lub
- ≥10 papierosów dziennie przez co najmniej 20 lat oraz ≤10 lat od zaprzestania palenia papierosów
- U bezobjawowych osoby z grupy ryzyka z punktu widzenia wczesnego rozpoznawania korzystna jest wykonywana corocznie niskodawkowa tomografia komputerowa.
- Niskodawkowa spiralna tomografia komputerowa
- zaleta: możliwość wykrycia nawet niewielkich guzów obwodowych przed rozsianiem nowotworu
- wada: duże obciążenie promieniowaniem
Procedury, których nie należy wykonywać
- U bezobjawowych osób z grupy ryzyka raka płuc nie należy wykonywać badań przesiewowych przy użyciu następujących metod:
- zdjęcia przeglądowe klatki piersiowej
- cytologia plwociny
- bronchoskopia
- biomarkery, np.:
- klasyczne markery nowotworowe
- biopsje płynów
- analizy gazów wydechowych
Postępowanie diagnostyczne
- Wyniki badań rentgenowskich mogą nasuwać mocne podejrzenia diagnostyczne.
- Masy w klatce piersiowej są nierzadko wykrywane przypadkowo podczas zwykłego badania rentgenowskiego lub tomografii komputerowej klatki piersiowej lub jamy brzusznej.
- Do potwierdzenia diagnozy i określenia typu nowotworu potrzebne jest badanie histologiczne, ewentualnie uzupełnione o diagnostykę molekularną.
- Konieczne są dalsze badania, aby określić stopień zaawansowania nowotworu (klasyfikacja TNM) i, ewentualnie, rozpoznać choroby współistniejące.
Diagnostyka różnicowa
- Gruźlica
- Sarkoidoza
- Zapalenie płuc
- Inne nowotwory umiejscowione w płucach lub opłucnej
- rakowiaki
- międzybłoniaki
- mięsaki
- guzy zarodkowe
- Przerzuty do płuca z innej choroby nowotworowej
Wywiad lekarski
- Osoba paląca duże ilości papierosów (>15 papierosów dziennie)?
- Związane z pracą zawodową narażenie na kontakt z azbestem, metalami ciężkimi, węglowodorami wielopierścieniowymi, promieniowaniem jonizującym, spalinami z silników wysokoprężnych (np. kierowcy ciężarówek) lub inne czynniki rakotwórcze?
- Zamieszkiwanie w regionie o wysokim zanieczyszczeniu radonem?
- Inne czynniki predysponujące?
- Wczesne objawy
- objawy ze strony układu oddechowego trwające ponad 6 tygodni?
- kaszel (65%), zaostrzenie kaszlu palacza?
- krwioplucie (35%)
- nawracające zakażenia dróg oddechowych z zapaleniem oskrzeli
- Często dopiero później:
- bóle w klatce piersiowej (50%)
- problemy z oddychaniem (60%)
- chrypka
- zapalenie płuc
- zmęczenie
- Utrata masy ciała
Badanie przedmiotowe
- Objawy kliniczne są różne, mogą też nie występować wcale.
- Guzy ośrodkowe mogą prowadzić do niedodmy i spowodowanego zwężeniem dróg oddechowych zapalenia płuc ze szmerami oddechowymi.
- Guzy obwodowe zwykle nie powodują objawów klinicznych.
- Naciekanie opłucnej powoduje wysięk opłucnowy.
- U ok. 20% pacjentów
- limfadenopatia (szyja/dół nadobojczykowy)
- hepatomegalia
- zespół żyły głównej górnej
- pałeczkowatość palców
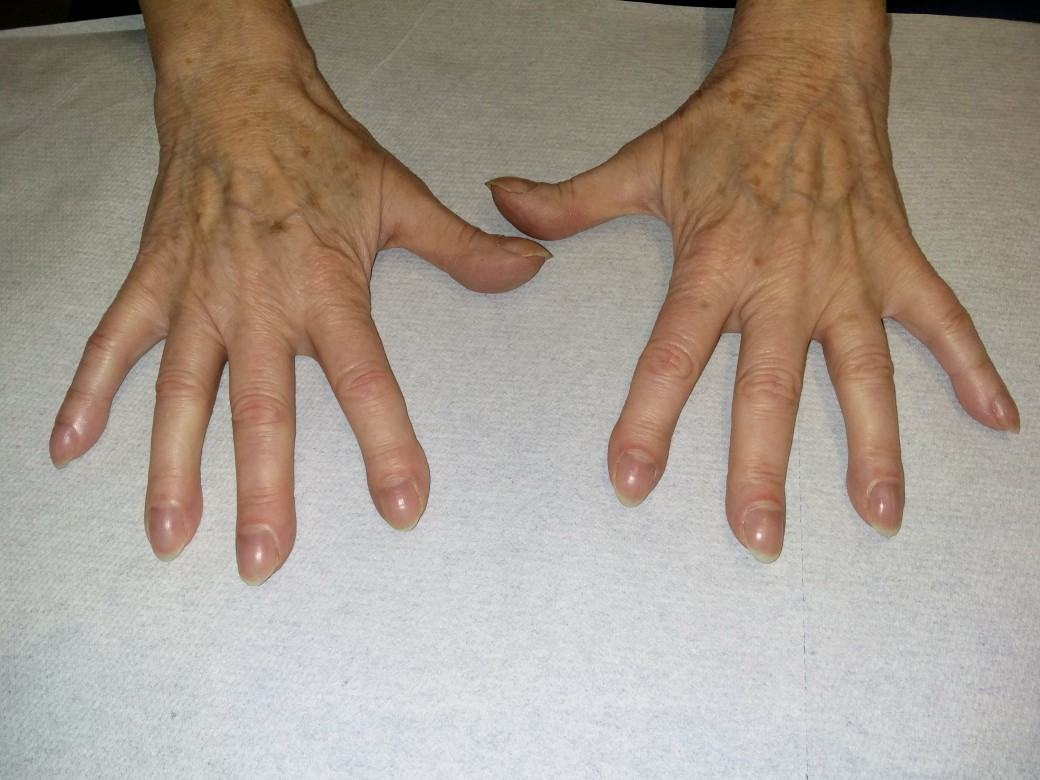 Pałeczkowatość palców
Pałeczkowatość palców
- Przerzuty do mózgu mogą być pierwszą manifestacją i dają następujące objawy:
- ból głowy
- nudności i wymioty
- niedowład połowiczny
- ubytki pola widzenia
- inne ogniskowe deficyty neurologiczne
- napady padaczkowe
- splątanie
- zmiany osobowości
- zaburzenia świadomości
- Rzadko (<5%)>
- zespół Hornera wywołany guzem Pancoasta zlokalizowanym w rejonie szczytu płuca
- trudności w oddychaniu spowodowane porażeniem nerwu krtaniowego wstecznego
- przerzuty do skóry
Objawy rozprzestrzeniania się guza wewnątrz klatki piersiowej
- U 40% wszystkich pacjentów już w ramach początkowej manifestacji występują objawy przedmiotowe i podmiotowe rozprzestrzeniania się guza wewnątrz klatki piersiowej — albo w postaci inwazyjnego miejscowego wzrostu guza, albo poprzez przerzuty limfogenne.
- Chrypka wskutek uszkodzenia nerwu krtaniowego wstecznego
- Porażenie przepony spowodowane zajęciem nerwu przeponowego
- dolegliwości oddechowe
- uniesiona przepona po lewej stronie (RTG klatki piersiowej)
- Rak szczytu płuca (guz Pancoasta) z zajęciem zwojów współczulnych i splotu ramiennego
- zespół Hornera
- neuropatyczny ból ramienia i barku
- zaburzenia czucia, niedowłady i atrofia mięśni przedramienia i dłoni
- Uporczywy ból opłucnowy spowodowany naciekaniem ściany klatki piersiowej
- Wysięk opłucnowy
- problemy z oddychaniem
- w badaniu osłuchowym: osłabiony szmer oddechowy
- stłumiony odgłos opukowy
- Zaburzenia połykania spowodowane inwazją guza lub uciskiem na przełyk
- Niedrożność żyły głównej górnej
- zastój żylny w obrębie szyi i górnej części ciała, łącznie z barkami i ramionami
- obrzęk twarzy
- hiperwolemia
- Jak wynika z badań post mortem, naciekanie osierdzia jest powszechne, ale rzadko daje objawy kliniczne w postaci wysięku osierdziowego lub tamponady.
Objawy i oznaki rozprzestrzeniania się guza poza klatkę piersiową
- Niemal 1/3 wszystkich pacjentów z rakiem płuca wykazuje objawy przedmiotowe i podmiotowe rozprzestrzeniania się guza poza klatkę piersiową.
- Typowe umiejscowienie przerzutów
- kości
- wątroba
- nadnercza
- węzły chłonne
- mózg
- rdzeń kręgowy
- Objawy nieswoiste
- osłabienie/zmęczenie
- utrata masy ciała
- Przerzuty do kości (głównie kości długich lub kręgów)
- ból
- złamania
- Na przerzuty wskazują wyczuwalne dotykiem węzły chłonne, a zwłaszcza limfadenopatia nadobojczykowa.
- Przerzuty do mózgu występują u 10% pacjentów. Rak płuc jest zatem chorobą nowotworową, która najczęściej daje przerzuty do mózgu. Mogą na to wskazywać następujące objawy:
- ból głowy
- nudności i wymioty
- niedowład połowiczny
- ubytki pola widzenia
- inne ogniskowe deficyty neurologiczne
- napady padaczkowe
- splątanie, zmiany osobowości, zaburzenia świadomości
- Pomimo częstego zajęcia wątroby: raczej rzadko zwiększenie aktywności transaminaz
Zespoły paraneoplastyczne
- Pozapłucne zaburzenia czynności narządów bez bezpośredniego związku z guzem pierwotnym lub przerzutami
- Uwalnianie substancji bioaktywnych lub autoprzeciwciał wytwarzanych przez sam nowotwór lub w odpowiedzi na nowotwór
- Dotyczy to ok. 10% pacjentów z rakiem płuc.
- Pierwsze wystąpienie przed rozpoznaniem, równolegle do rozpoznania lub po postawieniu diagnozy
- Różne rodzaje zespołów w zależności od zajętego układu narządów:
- endokrynne
- metaboliczne
- autoimmunologiczne (np. kolagenozy)
- nerwowo-mięśniowe (np. autonomiczne neuropatie obwodowe)
- kostne
- sercowo-naczyniowe
- hematologiczne
- skórne (np. zapalenie skórno-mięśniowe)
- nerkowe
- Leczenie tych powiązanych zespołów często ma decydujący wpływ na samopoczucie pacjentów.
Badania uzupełniające w gabinecie lekarza rodzinnego
- Morfologia krwi, morfologia krwi z rozmazem
- Elektrolity (Na, K, ewentualnie Ca oraz P)
- Parametry nerkowe (kreatynina, mocznik)
- próby wątrobowe (AST, ALT, Gamma GT, ALP, bilirubina)
- LDH
- układ krzepnięcia (wskaźnik Quicka/INR, PTT)
- Kwas moczowy
- Ew. markery nowotworowe
- Swoista enolaza neuronowa (NSE) może być podwyższona w przypadku drobnokomórkowego raka płuc.
- CEA może być podwyższony w gruczolakoraku.
Diagnostyka specjalistyczna
RTG klatki piersiowej
- Tradycyjne zdjęcia radiologiczne klatki piersiowej są za mało czułe i swoiste w wykrywaniu raka płuc.
- We wczesnym stadium wynik może być prawidłowy, szczególnie w przypadku guzów umiejscowionych ośrodkowo.
TK z kontrastem klatki piersiowej i nadbrzusza
- Wyższa czułość niż w przypadku zwykłego badania rentgenowskiego w wykrywaniu wczesnych stadiów choroby
RM z kontrastem
- W szczególnych przypadkach, np. przy podejrzeniu pojedynczych przerzutów do wątroby, przerzutów do mózgu lub kości (RM czaszki).
Badania w szpitalu
- Testy laboratoryjne
- Hb
- morfologia krwi z rozmazem
- parametry zapalne (OB, CRP)
- LDH
- kreatynina
- elektrolity (Na, K, ewentualnie Ca oraz P)
- wapń
- albumina
- ALT (ALAT)
- Gamma GT
- ALP
- bilirubina
- NSE
- ProGRP
- w razie potwierdzenia rozpoznania nowotworu płuca w razie potrzeby dalsze markery nowotworowe i swoiste parametry diagnostyczne zespołów paraneoplastycznych
- spirometria
- Obowiązkowo u wszystkich pacjentów, którzy mają być operowani w związku z rozpoznaniem raka płuc.
- Objawy kliniczne zespołów paraneoplastycznych, np:
- zespół nieadekwatnego wydzielania ADH (SIADH, zespół Schwartza-Barttera)
- zwiększone wydzielanie ACTH
- hiperkalcemia
- różne objawy neurologiczne
- zmiany skórne
- Poziom sprawności/funkcjonowania pacjenta ma kluczowe znaczenie w planowaniu terapii.
Diagnostyka obrazowa
- RTG klatki piersiowej z obrazami przekrojowymi (jeśli dostępne)
- typowe wyniki badań w przypadku nowotworu płuc
- zagęszczenie na obwodzie lub okrągły cień
- niedodma
- powiększona wnęka
- poszerzone śródpiersie
- wysięk opłucnowy
- w przypadku guzów umiejscowionych centralnie często wynik prawidłowy
- W razie utrzymującego się podejrzenia klinicznego należy wykonać tomografię komputerową klatki piersiowej i górnej części jamy brzusznej, nawet jeśli zdjęcie rentgenowskie klatki piersiowej nie wykazało zmian.
- typowe wyniki badań w przypadku nowotworu płuc
- TK z kontrastem klatki piersiowej i nadbrzusza
- ocena miąższu płuc, śródpiersia i opłucnej
- w przypadku powiększonych węzłów chłonnych (krótki wymiar >1 cm) w śródpiersiu: dalsze badania przed zabiegiem operacyjnym
- w nadbrzuszu: ocena wątroby i nadnerczy
- niezbędne do określenia stopnia zaawansowania nowotworu i planowania leczenia
- RM z kontrastem klatki piersiowej i jamy brzusznej
- Tylko jeśli nie można wykonać TK, na przykład gdy pacjent nie wyraził zgody.
- Rezonans magnetyczny klatki piersiowej nie jest zalecany jako rutynowe badanie służące do oceny stopnia zaawansowania nowotworu płuca, ale ma pewną wartość w topograficznym określeniu możliwego zajęcia splotu ramiennego lub kręgosłupa lub w przypadku podejrzenia naciekania śródpiersia.
- Rezonans magnetyczny czaszki (ewentualnie TK)
- RM: badanie pierwszego wyboru w diagnostyce przerzutów do mózgu
- TK: tylko jeśli nie można wykonać RM.
- PET-TK (pozytonowa tomografia emisyjna plus tomografia komputerowa)
- W PET czynnikiem wzmacniającym sygnał jest zwiększony wychwyt glukozy przez komórki nowotworowe.
- Jeśli celem jest wyleczenie pacjenta, PET-TK przynosi korzyść w zakresie diagnostyki rozprzestrzeniania się choroby, pod warunkiem, że nie spowoduje znacznego opóźnienia leczenia.
- Umożliwia wczesną i dokładną diagnozę, a tym samym dłuższe przeżycie.
- Nie ma dowodów na korzyści z punktu widzenia późniejszej diagnostyki.
- Ew. scyntygrafia układu kostnego
- w przypadku bólu kości, podwyższonej ALP lub hiperkalcemii
- Ew. USG nadbrzusza
Anatomia patologiczna
- Wynik cytologii plwociny potwierdza rozpoznanie w 40–60% przypadków.
- U około połowy pacjentów onkologicznych z wysiękiem opłucnowym rozpoznanie weryfikuje cytologia płynu pobranego metodą punkcji opłucnej.
- Klasyfikacja histologiczna
- gruczolakorak
- rak płaskonabłonkowy
- rak wielkokomórkowy
- rak gruczołowo-płaskonabłonkowy
- rak drobnokomórkowy
- rakowiaki
- nowotwory w typie gruczołów ślinowych
- rak mięsakowy
- międzybłoniak
- przerzuty z innej jednostki
- Diagnostyka molekularna
- Obecnie znanych jest wiele czynników genetycznych, które można oznaczyć w tkance nowotworowej i które mają duże znaczenie dla rokowania i odpowiedzi na leczenie celowane molekularnie.
- Są to m.in.:
- mutacje genu EGFR
- mutacje genu BRAF V600
- mutacje genu KRAS
- fuzje ALK
- fuzje ROS1
- fuzje RET
- fuzje NTRK1–3
- ekspresja PDL-1
Diagnostyka inwazyjna
- Bronchofiberoskopia
- Umożliwia potwierdzenie rozpoznania w 60–90% guzów umiejscowionych centralnie, ale tylko w ok. 10% guzów zlokalizowanych obwodowo.
- wskazana w przypadku podejrzenia wynikającego z badań obrazowych i przy dostępności guza
- u wszystkich pacjentów z obwodowym naciekiem płuc w celu
- wykluczenia guza błony śluzowej oskrzeli
- wykonania płukania oskrzeli i biopsji szczoteczkowej w odnośnym segmencie
- oceny stopnia zaawansowania za pomocą przezoskrzelowej biopsji aspiracyjnej z regionalnych węzłów chłonnych
- Badanie przeprowadza się w znieczuleniu miejscowym, ewentualnie w warunkach ambulatoryjnych.
- Przezskórna biopsja płuca
- Przezklatkową biopsję aspiracyjną igłową wykonuje się w przypadku guzów zlokalizowanych obwodowo, w znieczuleniu miejscowym i pod kontrolą fluoroskopii rentgenowskiej.
- Pozwala potwierdzić diagnozę w 60–80% przypadków.
- 10% wyników fałszywie ujemnych
- w przypadku nieswoistych łagodnych zmian: torakoskopia lub minitorakotomia
- częste powikłanie (25–30%): odma opłucnowa
- Nakłucie opłucnej w przypadku wysięku opłucnowego
- Materiał z punkcji poddaje się badaniu cytologicznemu.
- Złośliwy wysięk opłucnowy zwykle występuje tylko w zaawansowanych stadiach choroby i przeważnie wyklucza interwencje chirurgiczne i radioterapię z zamiarem wyleczenia.
- Jeśli wynik cytologii jest niejednoznaczny, konieczna może być torakoskopia lub biopsja opłucnej.
- Biopsja opłucnej
- pod kontrolą fluoroskopii rentgenowskiej w znieczuleniu miejscowym
- Torakoskopia
- w znieczuleniu miejscowym lub ogólnym
- W przypadku nowotworu złośliwego pleurodezę można wykonać przy okazji drenażu jamy opłucnej.
- Mediastinoskopia
- do celów klasyfikacji histologicznej N węzłów chłonnych w śródpiersiu przednim
- w znieczuleniu ogólnym
- Pod kontrolą USG wykonuje się przezprzełykowo biopsję węzłów chłonnych w śródpiersiu.
- dostęp nadmostkowy albo lewy przymostkowy
- Znajduje zastosowanie w sytuacji, gdy powiększone węzły chłonne są niedostępne podczas użycia innych metod biopsji, ponieważ np. znajdują się w oknie aortalno-płucnym.
- Inne metody biopsji
- Mogą być konieczne w celu zdiagnozowania odległych przerzutów, np. z obwodowych węzłów chłonnych, skóry, kości, nadnerczy i innych narządów.
- Standardowymi procedurami w ocenie stopnia zaawansowania raka drobnokomórkowego są zatem badania obrazowe nadbrzusza w celu wykrycia przerzutów i badania szpiku kostnego.
Pobranie próbek do badań morfologicznych
Przedoperacyjne badanie czynności płuc
- Istotne powikłania pooperacyjne dotyczą głównie funkcji oddechowej.
- Najważniejsze badanie przedoperacyjne: spirometria
- Jeśli natężona objętość wydechowa pierwszosekundowa (FEV1) i zdolności dyfuzyjna gazów w płucach przekraczają 60% oczekiwanej wartości prawidłowej, można wykonać pneumonektomię.
- Jeśli wartości są niższe niż 60%, wykonuje się selektywne badanie czynności płuc ze scyntygrafią perfuzyjną.
- Istotny jest również pomiar maksymalnego poboru tlenu w warunkach obciążenia.
Wskazania do skierowania do specjalisty
- W razie podejrzenia raka płuc lub innej choroby nowotworowej
Leczenie
Cele leczenia
- Leczenie paliatywne
- Wyleczenie dotyczy ok. 10% pacjentów
Poradnictwo w gabinecie lekarza rodzinnego
- Komunikacja skoncentrowana na pacjencie
- Sposób przekazywania wiadomości i informowania pacjentów powinien być zgodny z następującymi podstawowymi zasadami komunikacji skoncentrowanej na pacjencie, która umożliwia uczestnictwo w podejmowaniu decyzji:
- okazywanie empatii i aktywne słuchanie
- bezpośrednie i delikatne podejście do trudnych kwestii
- w miarę możliwości unikanie słownictwa medycznego, ewentualnie wyjaśnienie terminów fachowych
- strategie poprawy zrozumienia (powtarzanie, podsumowywanie ważnych informacji, wykorzystanie grafik itp.)
- zachęcanie do zadawania pytań
- umożliwienie wyrażania uczuć, zachęta do wyrażania uczuć
- oferowanie dalszej pomocy
- Lekarz może doskonalić swoje umiejętności komunikacyjne, uczestnicząc w odpowiednio zorganizowanym szkoleniu z zakresu komunikacji.
- Sposób przekazywania wiadomości i informowania pacjentów powinien być zgodny z następującymi podstawowymi zasadami komunikacji skoncentrowanej na pacjencie, która umożliwia uczestnictwo w podejmowaniu decyzji:
- Poinformowanie o rozpoznaniu
- Informacje o chorobie i jej przebiegu powinien przekazywać przede wszystkim lekarz prowadzący.
- Wszystkie grupy zawodowe zaangażowane w leczenie powinny wspierać pacjenta w radzeniu sobie z diagnozą.
- Należy w czytelny sposób dokumentować zrealizowany etap procesu wyjaśniania.
- Przed udzieleniem informacji należy zapytać chorego o jego wiedzę, wyobrażenia, nadzieje i obawy związane z chorobą.
- Informacje należy przekazywać stopniowo i należy regularnie się upewniać, czy i w jakim stopniu pacjent je zrozumiał. Należy przy tym wyraźnie zachęcać pacjenta do zadawania pytań.
- Trzeba przy tym uwzględnić i uszanować bliskich jako osoby wspierające i współdotknięte chorobą.
- Należy je zapytać o ich potrzeby i w razie potrzeby zachęcić do przyjęcia wsparcia, jeśli jest ono konieczne.
- Planowanie opieki z wyprzedzeniem (advance care planning, ACP)
- Pacjentom z nieuleczalnym rakiem płuca należy zaoferować planowanie opieki z wyprzedzeniem.
- Tematem rozmów powinno być:
- zakres i granice leczenia w przypadku typowych (dla choroby), jak również częstych i możliwych scenariuszy i powikłań
- indywidualne preferencje dotyczące opieki w ostatniej fazie życia, miejsca opieki i śmierci i ewentualnie pogrzebu
- wyznaczenie pełnomocników lub zaproponowanie osoby sprawującej opiekę
- Rozmowa o śmierci i umieraniu
- Pacjentom z nieuleczalnym rakiem płuca należy na wczesnym etapie i w przypadku postępu choroby wyraźnie zasygnalizować gotowość do rozmowy o śmierci w wyniku choroby.
- W tym kontekście osoby zaangażowane w leczenie powinny wypowiadać słowa takie jak „umieranie” i „śmierć” w sposób delikatny i odpowiedni do sytuacji.
- Wyrażenie życzenia śmierci przez osobę z nieuleczalnym nowotworem powinno spotkać się z empatią i gotowością do rozmowy.
- Pacjentom z nieuleczalnym rakiem płuca należy na wczesnym etapie i w przypadku postępu choroby wyraźnie zasygnalizować gotowość do rozmowy o śmierci w wyniku choroby.
- Aby ocenić indywidualną potrzebę pomocy i zorganizować odpowiednią opiekę na miejscu, należy uzyskać informacje w następujących obszarach:
- sytuacja mieszkaniowa
- więzi społeczne (rodzina, przyjaciele, sąsiedzi)
- sytuacja zawodowa
- dostępne usługi opiekuńcze
- Doradztwo w sprawach społecznych i związanych z ubezpieczeniem nie tylko podczas aktywnej choroby, ale także w fazie rekonwalescencji
Ogólne informacje o leczeniu
- Do metod leczenia nowotworów płuc należą — osobno lub w połączeniu — resekcja chirurgiczna, terapia radiacyjna i chemoterapia.
- O rodzaju i kolejności leczenia decyduje:
- stopień rozprzestrzenienia się choroby (stadium)
- biologia guza, w tym charakterystyka histologiczna i molekularna
- ogólny stan fizyczny pacjenta
- choroby współistniejące
- Do operacji kwalifikuje się około 25% pacjentów.
- Chemoterapia i terapia radiacyjna wykazują zazwyczaj ograniczoną skuteczność.
Drobnokomórkowy rak płuc (SCLC)
- Drobnokomórkowy rak płuc (SCLC) daje większe prawdopodobieństwo obecności przerzutów w momencie rozpoznania niż inne typy nowotworów płuc. W momencie rozpoznania u około 35% pacjentów choroba jest ograniczona do jednej połowy klatki piersiowej (limited disease, LD), u 65% wykracza poza ten obszar (choroba rozległa, extensive disease, ED). SCLC, niezależnie od stadium w momencie rozpoznania, uznaje się zawsze za chorobę ogólnoustrojową.
- Terapia radiacyjna i cytostatyki zwykle przynoszą efekt.
- Obok poniższych zaleceń odnoszących się do poszczególnych stadiów decydujące znaczenie w wyborze leczeniu mają także inne czynniki, w tym wiek, sprawność fizyczna i preferencje chorego:
- stadium I–IIA
- resekcja guza pierwotnego (jeśli operacja nie jest możliwa, postępować jak w stadium IIB–III)
- 4 cykle cisplatyny/etopozydu
- następnie, w razie potrzeby, profilaktyczna terapia radiacyjna czaszki
- stadium IIB–III
- jednoczesna radiochemioterapia
- następnie profilaktyczna terapia radiacyjna czaszki
- stadium IV
- cytostatyki + immunoterapia inhibitorami punktów kontrolnych: 4–6 cykli karboplatyny/etopozydu w skojarzeniu z przeciwciałami PD-L1 (atezolizumab lub durvalumab)
- następnie leczenie podtrzymujące przeciwciałami PD-L1
- w przypadku przerzutów do mózgu w razie potrzeby tylko chemoterapia i terapia radiacyjna czaszki
- stadium I–IIA
Niedrobnokomórkowy rak płuc (NSCLC)
- Około 70% wszystkich pacjentów z NSCLC jest diagnozowanych w takim stadium choroby, w którym leczenie z zamiarem wyleczenia nie jest możliwe — albo ze względu na osiągnięcie stadium IV (40%), albo w związku z występowaniem niekorzystnych czynników rokowniczych we wcześniejszym stadium (30%).
- Chirurgia
- Chirurgiczna resekcja tkanki nowotworowej, w miarę możliwości całkowita, jest najważniejszym sposobem leczenia z zamiarem wyleczenia.
- Jednak w chwili pierwszego badania do operacji kwalifikuje się tylko 25% pacjentów.
- Spośród nich tylko u połowy można przeprowadzić zabieg radykalnej torakotomii.
- Chemoterapia
- Zwykle sama chemoterapia nie prowadzi do wyleczenia.
- Pooperacyjne leczenie oparte na cisplatynie wydłuża przeżycie.
- Skojarzenia dwóch leków cytostatycznych mają przewagę nad monoterapią. Potrójne skojarzenia nie wydłużają przeżycia, skutkują natomiast zwiększeniem toksyczności.
- Terapie celowane molekularnie
- inhibitory kinaz tyrozynowych
- w stadiach IB–IIIA w przypadku określonych mutacji aktywujących EGFR (del 19, L858R): ozymertynib
- Inne możliwe do zastosowania substancje — zobacz poniżej.
- immunoterapia inhibitorami punktów kontrolnych z użyciem inhibitorów PD1
- w przypadku ekspresji PD-L1 na komórkach nowotworowych ≥50% w stadiach IIA–IIIA z genami EGFR/ALK typu dzikiego: atezolizumab
- Inne możliwe do zastosowania substancje — zobacz poniżej.
- Wskazane również w określonych warunkach (zobacz poniżej).
- przeciwciała przeciwko receptorom czynników wzrostu
- inhibitory angiogenezy
- inhibitory kinaz tyrozynowych
- Terapia radiacyjna
- zamiar wyleczenia u wybranych pacjentów
- efekt paliatywny wobec większości objawów związanych z rakiem płuc
- Można stosować również u pacjentów z nieoperacyjnymi guzami lub nawrotami po zabiegu operacyjnym.
- Terapia radiacyjna w połączeniu z chemoterapią w pierwotnie nieoperacyjnym stadium III wydłuża przeżycie w porównaniu z samą terapią radiacyjną.
- Wpływ na jakość życia nie jest jednoznaczny.
Leczenie farmakologiczne
- Chemoterapia skojarzona raka drobnokomórkowego przedłuża życie.
- W niedrobnokomórkowym raku płuca nowsze schematy leczenia mogą przynieść tymczasową subiektywną lub obiektywną poprawę w 20–30% przypadków.
- Wysoko oceniane są obecnie terapie celowane molekularnie, zwłaszcza w przypadku wykrycia mutacji onkogennych, np. w genach EGFR, EML4-ALK, ROS1 i BRAF V600.
Drobnokomórkowy rak płuc (SCLC)
- Najczęściej stosowane skojarzenia cytostatyków
- 1. wybór: cisplatyna/etopozyd
- Schematy zawierające antracykliny, na przykład doksorubicynę lub epirubicynę w skojarzeniu z cyklofosfamidem/winkrystyną lub etopozydem, są możliwą alternatywą dla terapii skojarzonych zawierających związki platyny, ale stosuje się je znacznie rzadziej w terapii pierwszego rzutu ze względu na kardiotoksyczność antracyklin. Terapia radiacyjna dodatkowo zwiększa kardiotoksyczność.
- Obiektywna odpowiedź występuje u 80–95% pacjentów.
- U pacjentów z rozległą chorobą czasami stosuje się doustne leczenie etopozydem.
- Immunoterapia (inhibitory immunologicznych punktów kontrolnych skierowane przeciw PD-1)
- Skuteczność przeciwciał PD-1 w SCLC wykazano w badaniach II fazy.
- Obecnie prowadzone są kontrolowane badania nad różnymi monoterapiami i terapiami skojarzonymi.
- Przeciwciała PD-1 nie zostały jeszcze dopuszczone do stosowania w leczeniu SCLC.
- Wstępne pozytywne efekty stwierdzono na przykład w odniesieniu do następujących przeciwciał PD-1 i ich skojarzeń:
- pembrolizumab
- niwolumab
- skojarzenie niwolumabu i ipilimumabu, przeciwciała CTLA-4 (Cytotoxic T-Lymphocyte Antigen-4)
- Inne terapie celowane molekularnie
- rowalpituzumab‑tezyryna
- Koniugat przeciwciała przeciwko białku delta-like 3 (DLL-3) i leku cytostatycznego
- W badaniach II fazy u około 1/3 pacjentów nastąpiła remisja po zastosowaniu tego leczenia, a u kolejnej 1/3 stabilizacja choroby bez progresji.
- Lek nie jest obecnie dopuszczony, trwają dalsze badania.
- W dotychczasowych badaniach nie udało się wykazać przewagi substancji antyangiogennych w aspekcie całkowitego przeżycia i dlatego nie są one wskazane ani w pierwszej, ani w drugiej linii leczenia.
- Negatywne wyniki przyniosły także inne badania fazy II dotyczące inhibitorów mTOR, inhibitorów HDAC i substancji antysensownych BCL-2.
- rowalpituzumab‑tezyryna
Niedrobnokomórkowy rak płuc (NSCLC)
- Chemoterapia pierwszego rzutu przynosi remisję u 20–30% pacjentów.
- Umiarkowane wydłużenie całkowitego przeżycia
- Adjuwantowa chemoterapia pooperacyjna może wydłużyć przeżycie, nawet jeśli zostanie rozpoczęta późno (7–18 tygodni po operacji)2.
- Terapie ogólnoustrojowe
- chemoterapia
- Standardem jest skojarzenie dwóch substancji.
- najczęściej w skojarzeniu z cisplatyną
- inne możliwe leki cytostatyczne to m.in. taksany, gemcytabina, pemetreksed lub winorelbina
- Leki celowane molekularnie są dopuszczone w wybranych wskazaniach.
- kryzotynib (inhibitor kinaz ROS1, ALK i MET)
- brygatynib (inhibitor kinaz ROS1, ALK, IGF-1R i EGFR)
- entrektynib (inhibitor kinaz ROS1, ALK, TRKA, TRKB i TRKC)
- lorlatynib (inhibitor kinazy ROS1 i ALK)
- larotrektynib (inhibitor kinaz TRKA, TRKB i TRKC)
- pralsetynib (inhibitor kinazy RET)
- selperkatynib (inhibitor kinaz RET, VEGFR1 i VEGFR3)
- inhibitory kinazy MET: kapmatynib, tepotynib
- inhibitory kinazy ALK: cerytynib, alecytynib
- inhibitory kinazy tyrozynowej EGFR: afatynib, dakomitynib, erlotynib, ozymertynib
- inhibitor kinazy MEK1/2 trametynib + inhibitor kinazy BRAF dabrafenib
- immunoterapia przeciwciałami anty-PD-1: niwolumab, pembrolizumab, atezolizumab
- nintedanib (inhibitor kilku kinaz, hamuje m.in. VEGFR i FGFR) + docetaksel
- ramucyrumab (inhibitor VEGFR2) + docetaksel
- bewacizumab (przeciwciała antyangiogenne) + chemoterapia skojarzona zawierająca związki platyny
- amiwantamab (hamowanie EGFR i c-Met)
- sotorasib (hamowanie KRASG12C)
- koniugat przeciwciała z lekiem
- trastuzumab-derukstekan (przeciwciało HER2 trastuzumab w skojarzeniu z cytostatycznie aktywnym inhibitorem topoizomerazy I, derukstekanem)
- chemoterapia
Terapia radiacyjna
- Może łagodzić kaszel, krwioplucie, duszność spowodowaną niedrożnością oskrzeli i ból kości związany z przerzutami.
- W przypadku objawowych przerzutów do mózgu dodatkowo podaje się kortykosteroidy w celu zmniejszenia obrzęku okołoogniskowego.
- Profilaktyczna terapia radiacyjna mózgu u pacjentów z drobnokomórkowym rakiem płuca i całkowitą remisją po radiochemioterapii
Chirurgia
- Zakres koniecznej resekcji zależy od stopnia rozprzestrzenienia tkanki nowotworowej i nie da się go w sposób pewny przewidzieć przed rozpoczęciem operacji.
- Lobektomia
- Procedura preferowana w przypadku ograniczenia guza do jednego płata.
- Przebieg pooperacyjny jest zwykle niepowikłany, a śmiertelność w ciągu 30 dni nie przekracza 2%.
- Pneumonektomia
- Jest wskazana rzadko.
- w przypadkach centralnego umiejscowienia guza
- Ze względu na większą utratę miąższu płuca i obciążenie prawego serca śmiertelność jest 2–3 razy wyższa niż po lobektomii.
- Ewentualnie dodatkowa resekcja osierdzia, ściany klatki piersiowej lub przepony w przypadku naciekania tych struktur
- Lobektomia mankietowa
- Lobektomia z jednoczesną resekcją głównego lub płatowego odcinka oskrzela
- W przypadku ośrodkowych guzów płata górnego można niekiedy dzięki temu uniknąć resekcji płata dolnego.
- Resekcja klinowa
- Odnosi się do drobnych zabiegów, takich jak segmentowa i subsegmentowa resekcja klinowa; może być stosowana w przypadku mniejszych guzów u pacjentów z ograniczoną czynnością płuc.
- Rozległe resekcje w przypadku chorób N2 i T3
- Są wskazane tylko w wybranych przypadkach.
- Resekcja ostrogi
- Pneumonektomia z jednoczesnym usunięciem ostrogi tchawicy i ograniczonej części oskrzela głównego po przeciwnej stronie i tchawicy
- Wykonywana w rzadkich przypadkach, jeśli guz jest umiejscowiony blisko ostrogi tchawicy i sklasyfikowany jako N0 lub N1.
- Chirurgia paliatywna
- Może być zaoferowana pacjentom nieoperacyjnym lub z nawrotem choroby.
- dostęp zwykle za pomocą bronchoskopu
- w przypadku naciekania guza lub ucisku głównego oskrzela, tchawicy lub przełyku
- umieszczenie stentu w świetle
- usuwanie masy guza za pomocą lasera lub krioterapii
Leczenie paliatywne
- Pacjentom z nieuleczalnym rakiem płuca należy po rozpoznaniu, na wczesnym etapie przedstawić możliwości połączonych konsultacji i opieki paliatywnej.
- Propozycję połączenia konsultacji i opieki paliatywnej dla pacjentów z nieuleczalnym rakiem płuca należy przedstawić na wczesnym etapie (w ciągu pierwszych 2 miesięcy od rozpoznania).
- Opieka paliatywna we wszystkich jej istotnych obszarach powinna być sprawowana przez wykwalifikowanych specjalistów (potrzeby fizyczne, psychologiczne, społeczne i duchowe) i dokumentowana.
- W ramach konsultacji i opieki paliatywnej nad pacjentami z nieuleczalnym rakiem płuc należy realizować następujące zadania:
- systematyczna ocena obciążenia fizycznego, psychospołecznego i duchowego oraz leczenie odpowiednich objawów
- doradztwo i koordynacja pomocy
- aktywne inicjowanie dyskusji na temat oświadczeń woli z uwzględnieniem możliwych powikłań i spraw związanych z końcowym etapem życia
- dostrzeganie obciążeń w kręgu rodziny i przyjaciół połączone z propozycją wsparcia
- doradztwo i pośrednictwo w opiece hospicyjnej, pielęgniarskiej i innych usługach opiekuńczych
- Badania wykazały pozytywne efekty wczesnych konsultacji i opieki paliatywnej, gdy
- kontakty miały miejsce przynajmniej raz w miesiącu oraz
- po pierwszym kontakcie następowały trzy kolejne
- Ustrukturyzowaną opiekę paliatywną u pacjentów z nieuleczalnym rakiem płuc należy włączyć do procesów decyzyjnych (np. udział w interdyscyplinarnych konsyliach onkologicznych lub dotyczących opieki paliatywnej).
- Leczenie paliatywne poszczególnych objawów:
Zapobieganie
- Ostrzeżenie przed paleniem
- Wskazówki dotyczące rzucenia palenia
- Rzucenie palenia znacząco zmniejsza ryzyko zachorowania na raka płuc.
- Szacuje się, że u osób, które rzuciły palenie w wieku 45–50 lat, ryzyko to zmniejsza się o 90%3.
- Rzucenie palenia może poprawić rokowanie nawet we wczesnych stadiach raka płuc.
- Należy unikać kontaktu z promieniowaniem jonizującym i substancjami rakotwórczymi w związku z wykonywaną pracą.
- Środki ochrony strukturalnej w regionach o zwiększonym narażeniu na kontakt z radonem
- Aktywność fizyczna
- Dieta bogata w owoce i warzywa
- Jak pokazują metaanalizy, suplementy diety, takie jak witamina A, C, E lub selen, nie mają działania zapobiegawczego w odniesieniu do nowotworów płuc3.
Przebieg, powikłania i rokowanie
Przebieg
- Objawowy rak płuca jest zwykle zaawansowany i nieoperacyjny w momencie rozpoznania.
- Chorobę zlokalizowaną rozpoznaje się w 10–15% przypadków. 50% z tych pacjentów umiera po 5 latach, nawet jeśli operację wykonywano z zamiarem wyleczenia.
- Ponad połowa ma odległe przerzuty w momencie rozpoznania.
Rak drobnokomórkowy
- Umiejscowiony centralnie
- Powoduje ucisk oskrzeli.
- Często z przerzutami już w momencie rozpoznania
Rak płaskonabłonkowy
- Zlokalizowany przeważnie centralnie w oskrzelach
- Nowotwór rozwija się w świetle oskrzeli i dlatego można go wcześnie wykryć w badaniu cytologicznym plwociny.
- Naciekanie regionalnych węzłów chłonnych
Gruczolakorak i rak wielkokomórkowy
- Zasadniczo zbliżony przebieg kliniczny
- Zlokalizowane obwodowo w płucach
- Częste przerzuty odległe
Powikłania
- Przerzuty: Często do wątroby, mózgu, kości, serca, jamy brzusznej, skóry
- Wysięk opłucnowy o charakterze złośliwym
- Zespół żyły głównej górnej
- Porażenie nerwu przeponowego
- Porażenie nerwu krtaniowego wstecznego
- Zwężenie oskrzela lub tchawicy
- Zwężenie przełyku
- Niewydolność oddechowa
- Niewydolność prawokomorowa
- Udar
Rokowanie
- U większości pacjentów z dłuższym okresem przeżycia wykonano resekcję guza pierwotnego. Kompletność resekcji wydaje się być najważniejszym czynnikiem prognostycznym w stadium Ia–IIb.
- Ponad połowa wszystkich pacjentów z rakiem płuc umiera w ciągu roku od rozpoznania. Średni czas przeżycia wynosi 10–12 miesięcy, a 5-letni wskaźnik przeżycia nie przekracza 20%.
- Wskaźnik 5-letniego przeżycia w przypadku resekcji raka płaskonabłonkowego wynosi 35–40%, a w przypadku gruczolakoraka i raka wielkokomórkowego — 25%.
- W poszczególnych podgrupach genetycznych możliwe jest osiągnięcie znacząco wyższych wskaźników odpowiedzi i przeżycia dzięki zastosowaniu terapii celowanych molekularnie. W nowotworach z mutacją EGFR — około 12% wszystkich nowotworów płuc — mediana czasu przeżycia wynosi około 3 lat.
- Czynniki prognostyczne:
- stadium w momencie rozpoznania
- ogólny stan zdrowia pacjenta
- wiek pacjenta
- histologiczna, molekularna i genetyczna charakterystyka nowotworu
- wskaźnik proliferacji guza
- rodzaj i intensywność leczenia
Moment rozpoznania
- Rokowanie jest uzależnione od stadium. Nowotwory płuc często wykrywa się dopiero w zaawansowanym stadium. Wcześniejsze rozpoznanie i leczenie mogłoby zmniejszyć zachorowalność i śmiertelność.
Znaczenie palenia
- 9 na 10 pacjentów z rakiem płuc to palacze lub byli palacze.
- Po rzuceniu palenia średnie ryzyko wprawdzie maleje, ale zawsze pozostaje powyżej poziomu osób, które nigdy nie paliły.
- Pacjenci z długim okresem przeżycia po przebytym raku płuc, którzy palili, nadal są bardziej narażeni na zachorowanie na raka.
- Między paleniem tytoniu a ryzykiem zachorowania na raka płuc istnieje zależność dawka–odpowiedź.
- Ryzyko rośnie wraz z liczbą wypalanych papierosów i latami palenia, ze stopniem uzależnienia od nikotyny (głębsze wdychanie), z zawartością substancji smolistych i nikotyny we wdychanym dymie.
- Palenie skrętów bez filtra oznacza podwójne ryzyko w porównaniu do papierosów z filtrem.
- U mężczyzn palących >40 papierosów dziennie ryzyko jest dwukrotnie wyższe niż u mężczyzn, którzy palą 20 papierosów dziennie.
- U mężczyzn, którzy zaczęli palić przed ukończeniem 15. roku życia, ryzyko jest 4 razy wyższe ryzyko niż u mężczyzn, którzy zaczęli palić po ukończeniu 25. roku życia.
- U palących kobiet ryzyko zachorowania na raka płuc jest wyższe niż u palących mężczyzn.
Dalsze postępowanie
- Leczeniem i późniejszą opieką zajmują się ośrodki specjalizujące się w nowotworach płuc, ewentualnie we współpracy z lekarzem rodzinnym.
Zadania lekarzy rodzinnych
- Leczenie działań niepożądanych chemoterapii i terapii radiacyjnej, zarówno w fazie aktywnego leczenia, jak i późnych (odczyny popromienne, zaburzenia metaboliczne, parestezje, zmęczenie, dolegliwości mięśniowo-szkieletowe itp.)
- Kontynuacja badań kontrolnych pod kątem nawrotów i późnych skutków choroby i leczenia
- Podczas leczenia cytostatykami należy monitorować parametry hematologiczne w porozumieniu z ośrodkiem prowadzącym leczenie.
W trakcie aktywnego leczenia
- Pierwsza rozmowa po wypisaniu ze szpitala
- Przejrzeć epikryzę z pacjentem, upewnić się, że pacjent rozumie jej treść, ustalić plan badań kontrolnych i pobierania krwi między ewentualnymi cyklami chemii i omówić objawy ostrzegawcze, w przypadku których pacjent powinien natychmiast skontaktować się z lekarzem rodzinnym lub ośrodkiem prowadzącym leczenie.
- Monitorowanie zakażeń i poziomu leukocytów
- Leukocyty zwykle osiągają najniższy poziom 7–14 dni po cyklu.
- Jeśli poziom leukocytów jest zbyt niski, by przeprowadzić następny cykl, należy omówić z kliniką dalsze postępowanie.
- Jeśli między cyklami chemoterapii u pacjenta wystąpi gorączka, należy postępować jak w sepsie i natychmiast przyjąć pacjenta na oddział. Dotyczy to temperatury ciała powyżej 38,5°C w jednym pomiarze lub powyżej 38,0°C w dwóch pomiarach wykonanych w odstępie dwóch godzin.
- Pacjent z gorączką i leukocytami poniżej 1 lub neutrofilami poniżej 0,5 musi być hospitalizowany i leczony tak jak w przypadku sepsy.
- Zwiększone ryzyko zdarzeń zakrzepowo-zatorowych u pacjentów z chorobą nowotworową
- aktywność fizyczna
- układanie nóg wyżej
- pończochy uciskowe
- ew. profilaktyka z zastosowaniem standardowej dawki heparyny drobnocząsteczkowej (enoksaparyna lub dalteparyna o bardzo niskim ryzyku powikłań krwotocznych)
- Stałe dostosowywanie terapii przeciwbólowej
- Leczenie działań niepożądanych leczenia, takich jak
:- nudności
- bóle neuropatyczne
- zmęczenie
- biegunka
- wysypki i zmiany popromienne na skórze
- owrzodzenia błony śluzowej
- nietrzymanie moczu i dysfunkcje seksualne
Po zakończeniu leczenia w szpitalu
- Należy skupić się na rozpoznawaniu działań niepożądanych związanych z leczeniem i wczesnej diagnostyce nawrotów.
- Szczepionka przeciwko pneumokokom po roku, a następnie co 5 lat w zależności od mierzalnego miana przeciwciał w surowicy
- Szczepienie przeciw grypie
- Rutynowe badania rentgenowskie nie są wskazane w gabinecie lekarza rodzinnego; to samo dotyczy rutynowych badań krwi, z wyjątkiem trwającej chemoterapii.
Zmęczenie
- Ciężkie, utrzymujące się wyczerpanie ze złym samopoczuciem, poczuciem braku siły i szybką męczliwością
- Brak poprawy lub niewystarczająca poprawa po odpoczynku lub śnie
- Bardzo często występuje u pacjentów onkologicznych, zwłaszcza w trakcie i po radioterapii lub leczeniu cytostatykami.
- Spośród wszystkich dolegliwości związanych z leczeniem największym obciążeniem dla pacjentów onkologicznych jest zmęczenie.
- Program lekkich ćwiczeń może ułatwić rehabilitację zawodową.
Informacje dla pacjentów
O czym należy poinformować pacjentów?
- Nigdy nie jest za późno, aby rzucić palenie.
- Palenie zwiększa ryzyko zachorowania na raka płuc lub inne nowotwory.
- Przypuszcza się, że niektóre metody leczenia, takie jak terapia radiacyjna, mogą być mniej skuteczne u palaczy niż u osób niepalących.
Informacje dla pacjentów w Deximed
Ilustracje

Palce pałeczkowate (za zgodą dr n. med. Ericha Ramstöcka)
Prawidłowe płuca i oskrzela
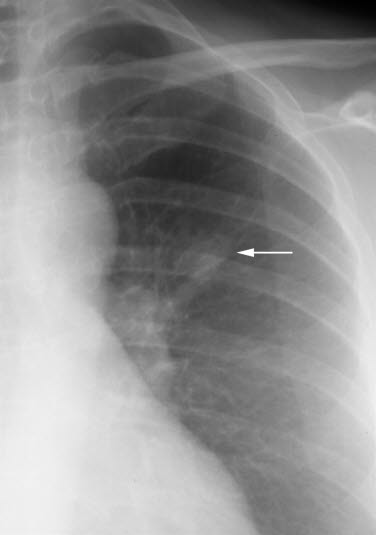
Rak płuc, RTG
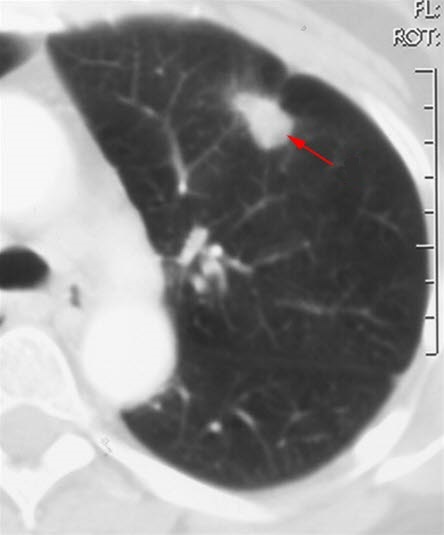
Rak płuc (TK)
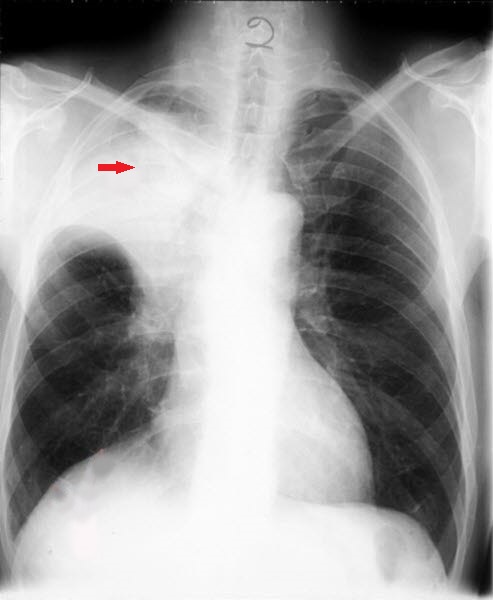
Drobnokomórkowy rak anaplastyczny, RTG
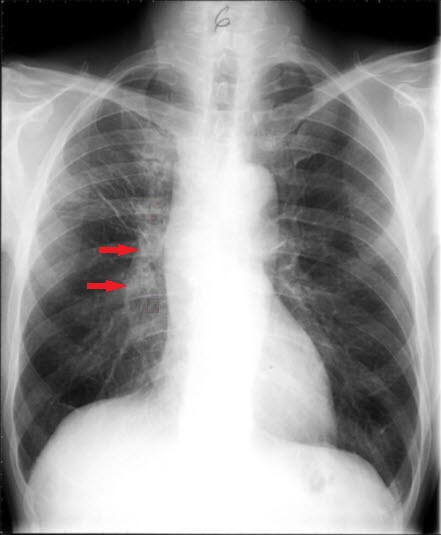
Drobnokomórkowy rak anaplastyczny, po leczeniu, RTG
Quellen
Literatur
- Travis WD, et al. The 2015 World Health Organization Classification of Lung Tumors: Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification. J Thorac Oncol, 2015. 10: 1243-60. PMID: 26291008 PubMed
- Salazar MC, Rosen JE, Wang Z, et al. Association of Delayed Adjuvant Chemotherapy With Survival After Lung Cancer Surgery. JAMA Oncol 2017 May 1; 3(5): 610-619. pmid:28056112 PubMed
- Cortes-Jofre M, Rueda JR, Asenjo-Lobos C, et al. Drugs for preventing lung cancer in healthy people. Cochrane Database Syst Rev 2020; 3: CD002141. www.cochranelibrary.com
Autor*innen
- Thomas M. Heim, Dr. med., Wissenschaftsjournalist, Freiburg